당신도 좋아할 수 있습니다
导读
暑假来袭,正是出门游玩的好时候。可对于过敏体质的人来说,这时候就怕过敏来凑热闹。过敏,常常被误认为是皮肤或是呼吸道的一种反应,实际上,过敏轻则影响日常生活,重则危及生命健康,属于世界上最常见的疾病。
每年7月8日是世界过敏性疾病日,全球范围内约有4 亿人患有过敏性鼻炎,3 亿人患有哮喘,2.5 亿人有食物过敏,已成为21世纪常见慢性疾病之一,被世界卫生组织(WHO)列为重点防治的三大疾病之一。
背景概述
过敏性疾病是一种常见病、多发病和潜在的致命疾病,又称变态反应性疾病,是一种特殊的病理性免疫反应,表现为机体通过吸入、食入、注入或接触等各种途径,接受某种过敏原刺激后,血液中对某种特殊的过敏原过敏的特异性免疫球蛋白E抗体(IgE),导致某一组织或器官甚至全身性的强烈、过激的免疫反应。
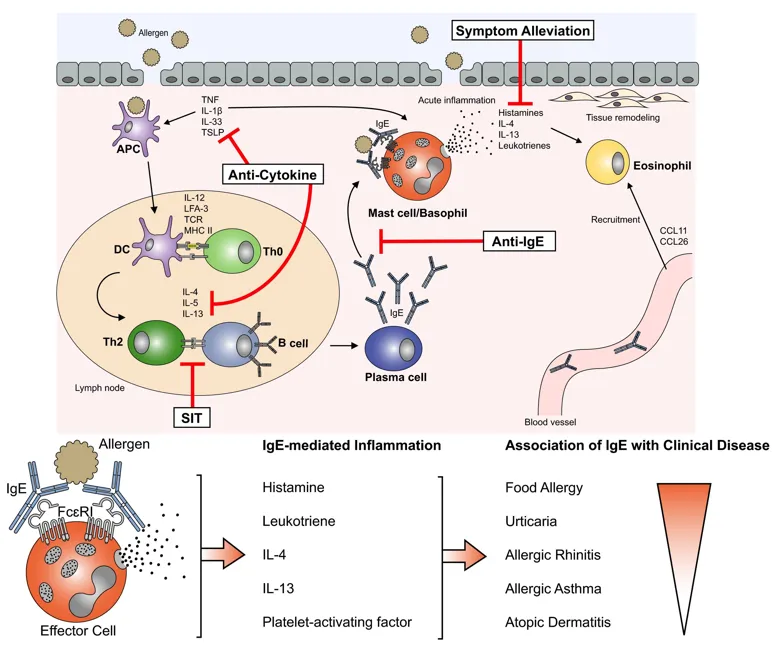
图1,IgE介导的过敏性疾病炎症[1]
过敏性疾病的发展进程[2]
致敏阶段:变应原初次进入机体后,选择诱导变应原特异性B细胞产生IgE类抗体反应应答,附着于肥大细胞和嗜碱性粒细胞上;
激发阶段:当再次接触到变应原后,变应原刺激致敏的肥大细胞和嗜碱性粒细胞,促进肥大细胞和嗜碱性粒细胞脱颗粒,释放活性物质;
效应阶段:释放的生物活性介质作用于机体各部位,引起平滑肌收缩,毛细血管扩张和通透性增强,腺体分泌物增多,可引起局部或全身过敏反应。
过敏性疾病的发病机制
IgE介导:当人体首次接触过敏原时,在2个小时之内迅速发病,由肥大细胞和IgE介导。过敏原进入体内,刺激单核吞噬系统,引起浆细胞反应,产生特异性IgE。这些IgE抗体会与肥大细胞表面的高亲和力FcεRI受体结合,使肥大细胞处于致敏状态。当再次接触相同过敏原时,过敏原会与肥大细胞表面的IgE抗体结合,导致肥大细胞脱颗粒,释放出组胺、白三烯、前列腺素等炎症介质,进而引起导致瘙痒、发红和肿胀等症状。
非IgE介导:除了IgE介导的过敏反应外,肥大细胞还可以通过其他途径被激活,如补体系统激活产生的C5a、某些神经递质、细胞因子等,这些物质可以直接作用于肥大细胞,使其释放炎症介质,引发过敏反应。
IgE敏感可导致以下几种典型的过敏性疾病:哮喘(Asthma)、特应性皮炎(AD)、过敏性鼻炎和食物过敏等,最常见的是由花粉、尘螨、真菌和宠物等致敏因素引起的过敏性鼻炎和过敏性哮喘。其中哮喘发病机制复杂,众多细胞因子(IL4、TSLP等)参与其中,阻断某一个细胞因子治疗哮喘只能达到部分效果,药物联合使用将是治疗该病的发展趋势。
BioMice百奥动物自主开发了一系列过敏性疾病相关靶点人源化小鼠,同时基于靶点人源化小鼠和野生型小鼠构建了相关疾病模型,如哮喘模型及特应性皮炎模型可用于药效评估,助力该疾病药物的临床前研究。部分模型数据如下:
FcεRI是参与过敏反应的关键因子,可通过诱导激活多种信号通路来控制过敏介质的分泌和诱导细胞因子基因转录[3]。在人肥大细胞中,FcεRI与IgE的Fc端交联后,β-亚基相关的LYN会被激活,同时磷酸化FcεRI的β和γ亚基中免疫受体酪氨酸的活化基序(ITAM)。β-和γ-亚基ITAM磷酸化后可募集额外的LYN和SYK分子。然后再磷酸化LYN酪氨酸,接着通过构象变化激活SYK与FcεRI复合物结合。SYK活化后可以磷酸化许多底物,其中包括激活TL细胞(LAT)的接头蛋白,含有SH2结构域的76kDa白细胞蛋白(SLP76),VAV,GRB2相关结合蛋白2(GAB2)和磷脂酶Cγ,继而激活一系列信号传导途径。
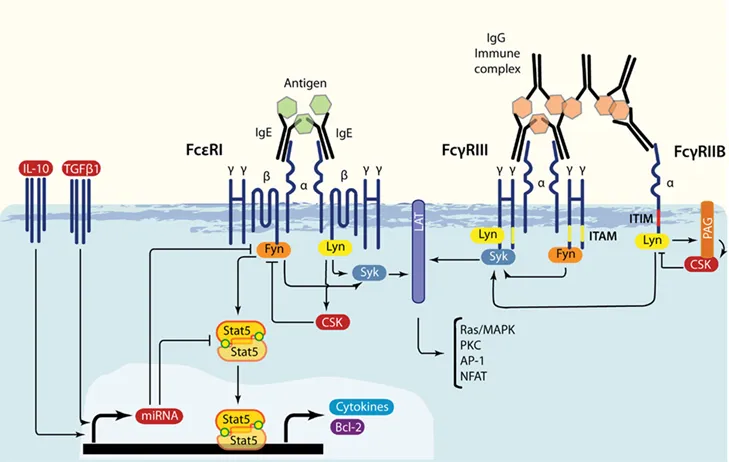
图2. IgE/FcεRI 介导的下游信号传导[3]
B-hIgE/hFCER1A mice
近年来随着对 IgE研究的不断深入,IgE在自身免疫性疾病中扮演的角色也越来越明朗;而且奥马珠单抗(omalizumab)在多种自身免疫性疾病中的治疗潜力也逐渐被发掘,希望可以随着研究的发展,有更多患者因奥马珠单抗获益。奥马珠单抗是一种重组人源化抗IgE的单克隆抗体,当与游离IgE结合,阻断其与受体FcεRI的结合,从而减少IgE对过敏级联反应的影响;FcεRI因无法结合IgE而被加速内吞,导致细胞表面FcεRI减少,细胞脱敏。
Omalizumab体内药效评价
主动全身过敏试验(ASA)是过敏原首次进入体内,刺激机体产生相应的抗体;当同样过敏原再次进入机体,抗原抗体复合物刺激肥大细胞及嗜碱性粒细胞释放活性介质,引起一系列生理反应,包括有局部水肿、抓鼻、竖毛、休克死亡等。
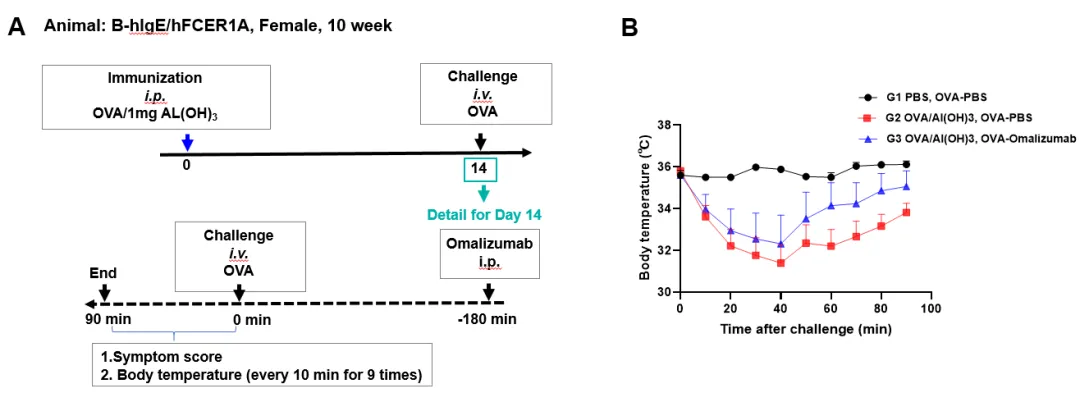
Omalizumab类似物(内部制备)对OVA诱导的ASA的作用。(A)B-hIgE/hFCER1A小鼠(H/H;H/H)于第0天接受 OVA/Al(OH)₃免疫,并在第14天接受OVA激发。Omalizumab(内部制备)在第14天激发前3小时注射。记录小鼠在激发后0至90分钟内的体温变化。(B)Omalizumab(内部制备)组体温相对于未给药组在ASA模型中呈现出上升趋势,表明其对B-hIgE/hFCER1A小鼠(H/H;H/H)ASA造模导致的体温下降具有抑制作用。
Omalizumab体内阻断实验
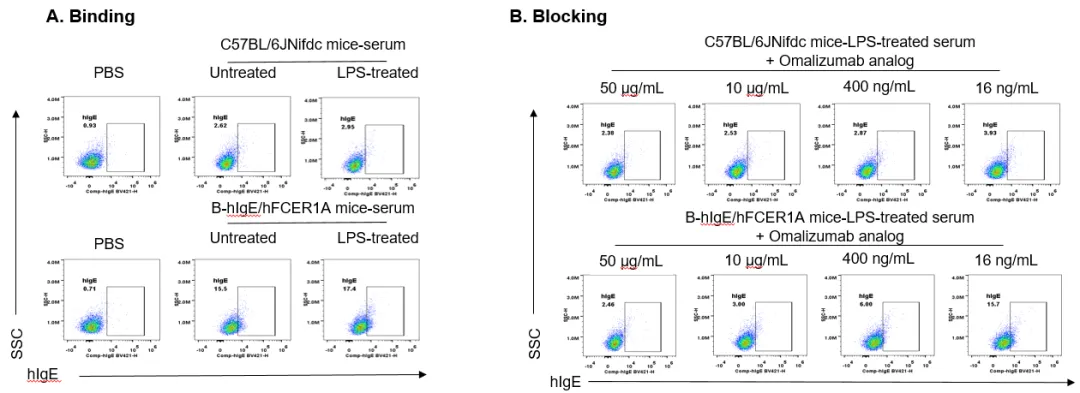
Omalizumab类似物(内部合成)对肥大细胞中IgE的阻断作用。B-hIgE/hFCER1A小鼠的骨髓细胞在小鼠IL-3蛋白培养条件下分化为肥大细胞和嗜碱性粒细胞。第8天加入小鼠血清并共孵育过夜,以评估人IgE的结合情况。如(A)所示,无论是否受到LPS刺激(刺激4小时后),B-hIgE/hFCER1A小鼠血清均可与来源于B-hIgE/hFCER1A小鼠的肥大细胞结合。而来自C57BL/6JNifdc小鼠的血清,无论是否受到LPS刺激(刺激4小时后),均未能与来源于B-hIgE/hFCER1A小鼠的肥大细胞结合。在37°C下,将LPS刺激4小时后收集的血清与不同浓度的Omalizumab类似物(内部合成)共孵育1小时,然后加入培养细胞,在4°C条件下过夜孵育,以测定肥大细胞表面IgE的结合情况。(B)Omalizumab类似物(内部制备)在50μg/mL和10μg/mL浓度下表现出显著的阻断作用,而在400ng/mL浓度下仍检测到一定程度的人IgE表达。在16ng/mL浓度下,Omalizumab类似物(内部制备)的阻断作用几乎可以忽略不计。
IL-4在许多免疫相关疾病,尤其是过敏性疾病和自身免疫性疾病中扮演着关键角色。IL-4/IL-5双抗的研发是近年来免疫治疗领域中的一个重要方向,尤其在治疗过敏性疾病、哮喘以及其他免疫介导疾病中显示出很大的潜力。
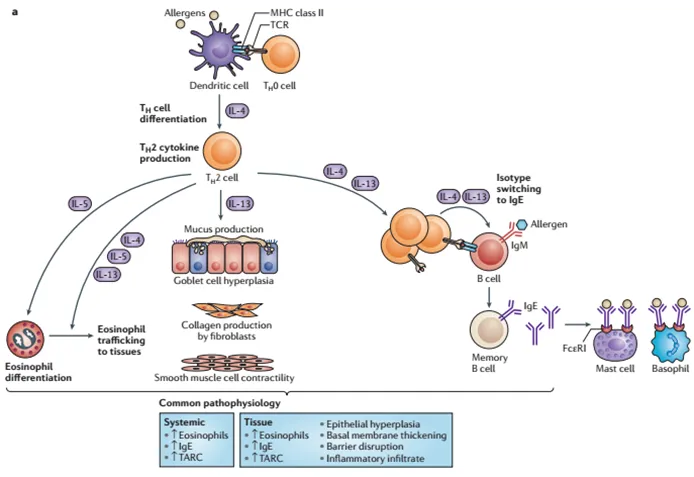
图3. IL-4信号通路示意图[4]
随着国内康方生物的AK139(IL-4Rα/ST2)和信达生物的IBI3002(IL-4R/TSLP)在近期陆续进入临床,IL-4及其相关受体的双抗治疗正逐渐成为自免领域的重点发展方向。这些新型双抗的研发,不仅为过敏性疾病提供了新的治疗策略,也为其他免疫系统疾病提供了潜在的治疗路径。AK139(IL-4Rα/ST2)主要通过靶向IL-4Rα和ST2信号通路,IBI3002(IL-4R/TSLP)则通过靶向IL-4R和TSLP通路,展示了双抗在免疫调节中的巨大潜力。
B-hIL4/hIL5/hIL4RA/hIL5RA mice
抗人IL4RA抗体联合抗人IL5抗体在哮喘小鼠模型中的体内疗效

通过流式细胞术分析BALF中的免疫细胞。使用B-hIL4/hIL5/hIL4RA/hIL5RA(雌性,8周龄)小鼠构建哮喘诱导模型。皮下注射抗人IL4RA抗体联合抗人IL5抗体。实验结束时收集支气管肺泡灌洗液(BALF),检测肺组织炎症细胞浸润情况。结果显示,造模组(G2-G3)诱导的嗜酸性粒细胞数量和频率均显著高于未造模组(G1),而造模组(G4)诱导的嗜酸性粒细胞数量和频率均显著低于未造模组(G2-G3)。数值以平均值±SEM表示。采用单因素方差分析(one-way ANOVA)检验。* p < 0.05, ** p < 0.01, *** p < 0.001。
注:抗体由RegeneCore Biotech Co., Ltd提供。
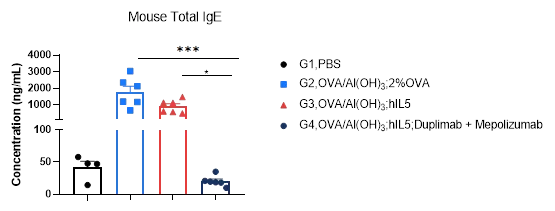
抗人IL4RA抗体联合抗人IL5抗体可显著降低小鼠哮喘模型血清总IgE。在研究终点收集血清。ELISA法检测血清IgE水平。结果显示,治疗组(G4)总IgE水平显著低于治疗组(G2-G3)。数值以平均值±SEM表示。采用单因素方差分析(one-way ANOVA)检验。* p < 0.05, ** p < 0.01, *** p < 0.001。
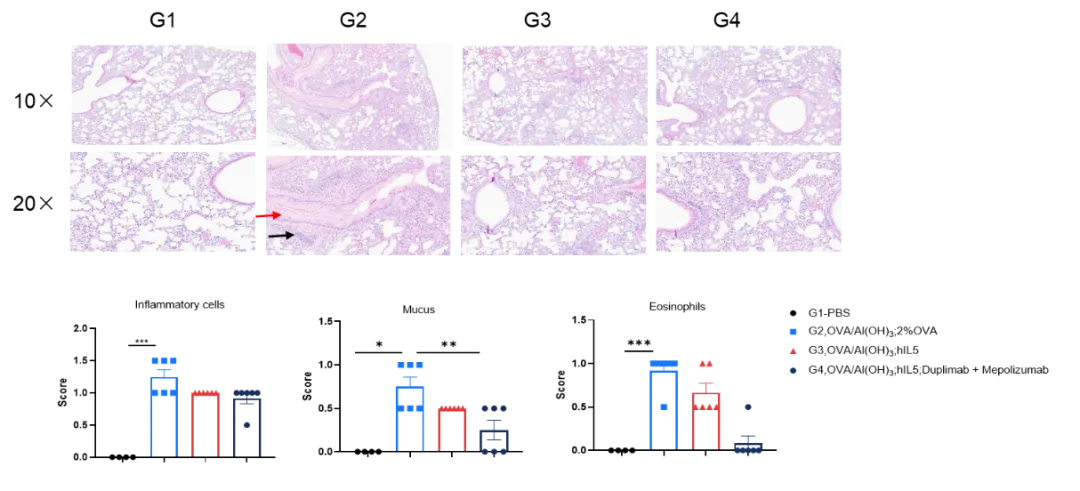
B-hIL4/hIL5/hIL4RA/hIL5RA小鼠哮喘模型H&E染色分析。在研究终点收集肺组织并进行H&E染色分析。结果显示,与未造模组(G1)相比,造模组(G2-G3)肺组织炎症浸润和粘液分泌明显减少。治疗组(G4)肺组织粘液分泌和嗜酸性粒细胞呈下降趋势。黑箭头:炎性细胞;红色箭头:粘液。数值以平均值±SEM表示。采用单因素方差分析(one-way ANOVA)检验。* p < 0.05, ** p < 0.01, *** p < 0.001。
TSLP(Thymic Stromal Lymphopoietin, 胸腺基质淋巴细胞生成素)最早从小鼠胸腺基质细胞系中发现,主要表达于活化的肺和肠表皮细胞,也被成为“警报素”(alarmin),其受体为由TSLPR和IL-7Ra组成的异源二聚体。TSLP可诱导II类免疫反应,也可直接作用于感觉神经元引起瘙痒,因此TSLP被认为是治疗这类疾病的潜在治疗靶点。
过敏原、细胞因子、病毒、细菌等多种触发因素可以激活肺和肠上皮细胞及角质形成细胞释放TSLP,并携带正电荷,TSLP与携带负电荷的TSLPR快速结合,然后与IL17Rα形成三元复合物,激活STAT3、STAT5和JAK2通路,启动促炎信号[5]。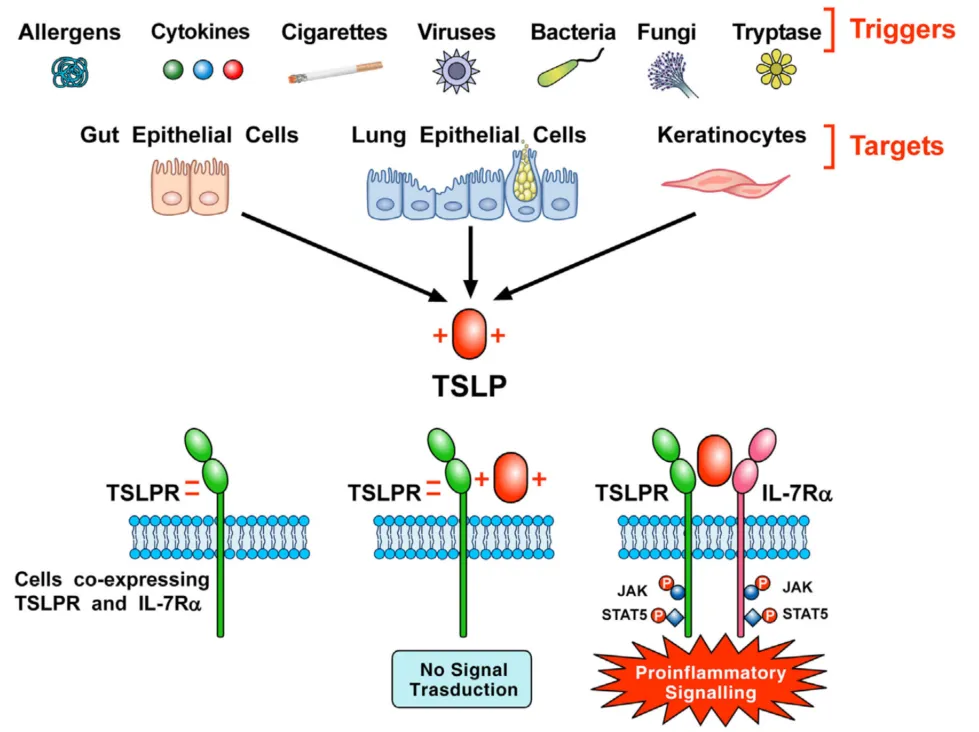
图4. TSLP及其信号复合体信号启动示意图[5]
TSLP是哮喘病理生理学的关键因子,在哮喘的治疗过程中,单独阻断某一个下游炎症因子(如IL-4、IL-5或IL-13)虽然可以在一定程度上缓解症状,但由于哮喘的发病机制复杂,涉及多个细胞因子、炎症通路和免疫细胞的交互作用,单靶点干预往往无法全面控制疾病的进展。
近年来的研究表明,针对多个关键炎症通路进行联合干预,尤其是通过双特异性或多特异性抗体同时阻断多个靶点(如TSLP联合IL-4受体),有望更有效地调控免疫反应,显著提升治疗效果。这种多靶点协同机制不仅能够覆盖更广泛的患者人群,也有潜力延缓疾病进展、减少急性发作频率,成为未来哮喘精准治疗的重要发展方向[6]。
B-hIL4/hIL4RA/hTSLP/hTSLPR plus mice
抗人IL4RA抗体联合抗人TSLP抗体在哮喘小鼠模型中的体内疗效
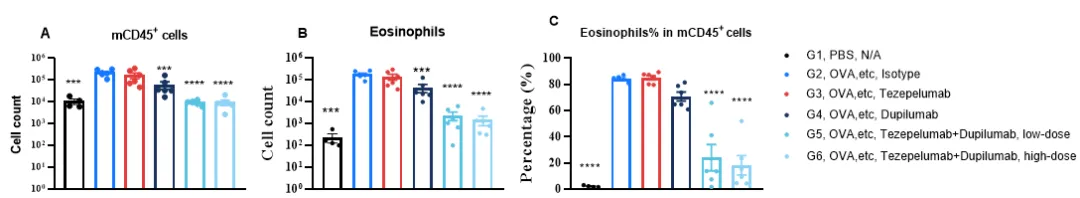
流式细胞术分析BALF中的免疫细胞。B-hIL4/hIL4RA/hTSLP/hTSLPR plus mice(雌性,6-8周龄)为OVA等诱导哮喘小鼠模型。腹腔注射抗人IL4RA抗体和抗人TSLP抗体。在实验结束时收集支气管肺泡液(BALF),以检测肺组织中的炎性细胞浸润。结果显示,治疗建模组(G2)诱导的嗜酸性粒细胞数量和频率明显高于非建模组(G1),而治疗组(G4-G6)中这些细胞的数量和频率与治疗造模组相比显著降低(G2)。值表示为平均值±SEM。通过单因素方差分析检验确定显著性。*P<0.05,**P<0.01,***P<0.001。
注:抗体由RegenerCore Biotech有限公司提供。

在用抗人IL4RA抗体联合抗人TSLP抗体治疗的小鼠哮喘模型中,血清中的总IgE显著降低。 在研究终点收集血清,并通过ELISA分析IgE水平。结果显示,总IgE治疗组(G4-G6)的水平明显低于治疗模型组(G2)。值表示为平均值±SEM。通过单因素方差分析检验确定显著性。*P<0.05,**P<0.01,***P<0.001。
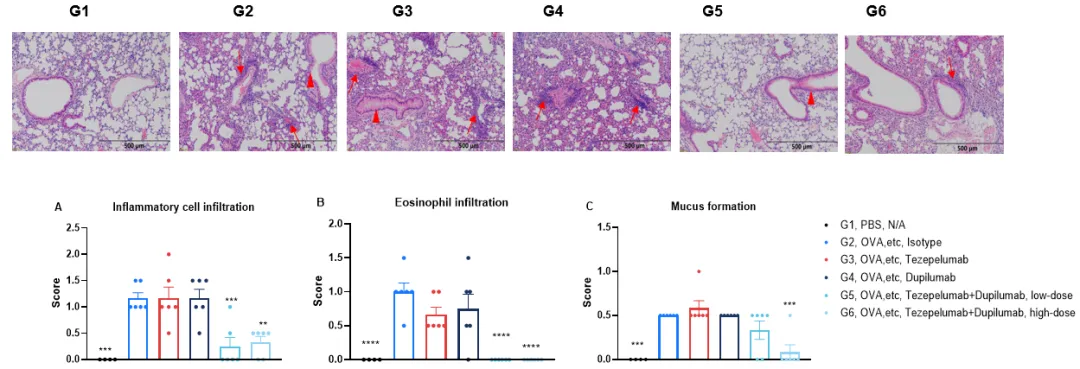
B-hIL4/hIL4RA/hTSLP/hTSLPR plus mice 哮喘模型的H&E染色。在研究终点收集肺组织,并用H&E染色进行分析。结果显示,与未建模组(G1)相比,建模组(G2)的肺组织炎症浸润和粘液分泌显著增加。治疗组(G5-6)显示肺组织炎症浸润和嗜酸性粒细胞显著减少。红色箭头:炎性细胞;红色三角形:粘液。值表示为平均值±SEM。通过单因素方差分析检验确定显著性。*P<0.05,**P<0.01,***P<0.001。
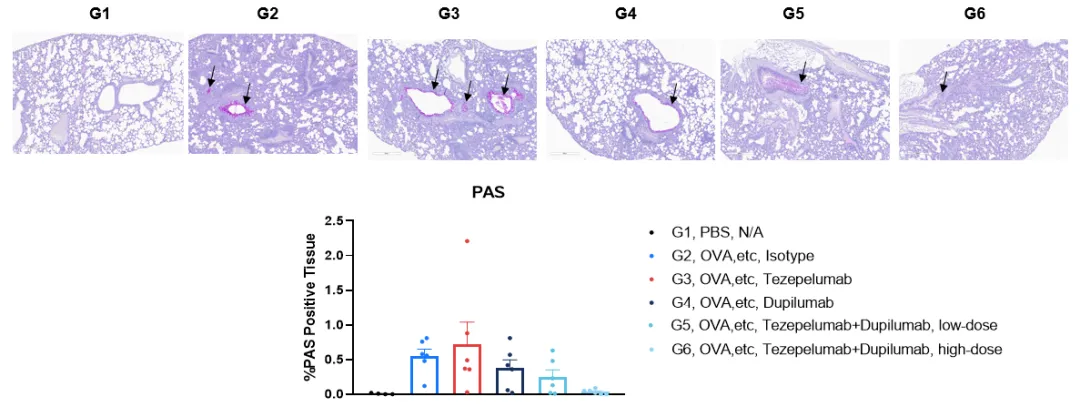
B-hIL4/hIL4RA/hTSLP/hTSLPR plus mice 哮喘模型的PAS染色。在研究终点收集肺组织,并用PAS染色进行分析。结果显示,与未建模组(G1)相比,建模组(G2)肺组织中PAS阳性信号呈下降趋势,显著减少。治疗组(G5-6)肺组织PAS阳性信号呈下降趋势。黑色箭头表示PAS阳性信号。值表示为平均值±SEM。
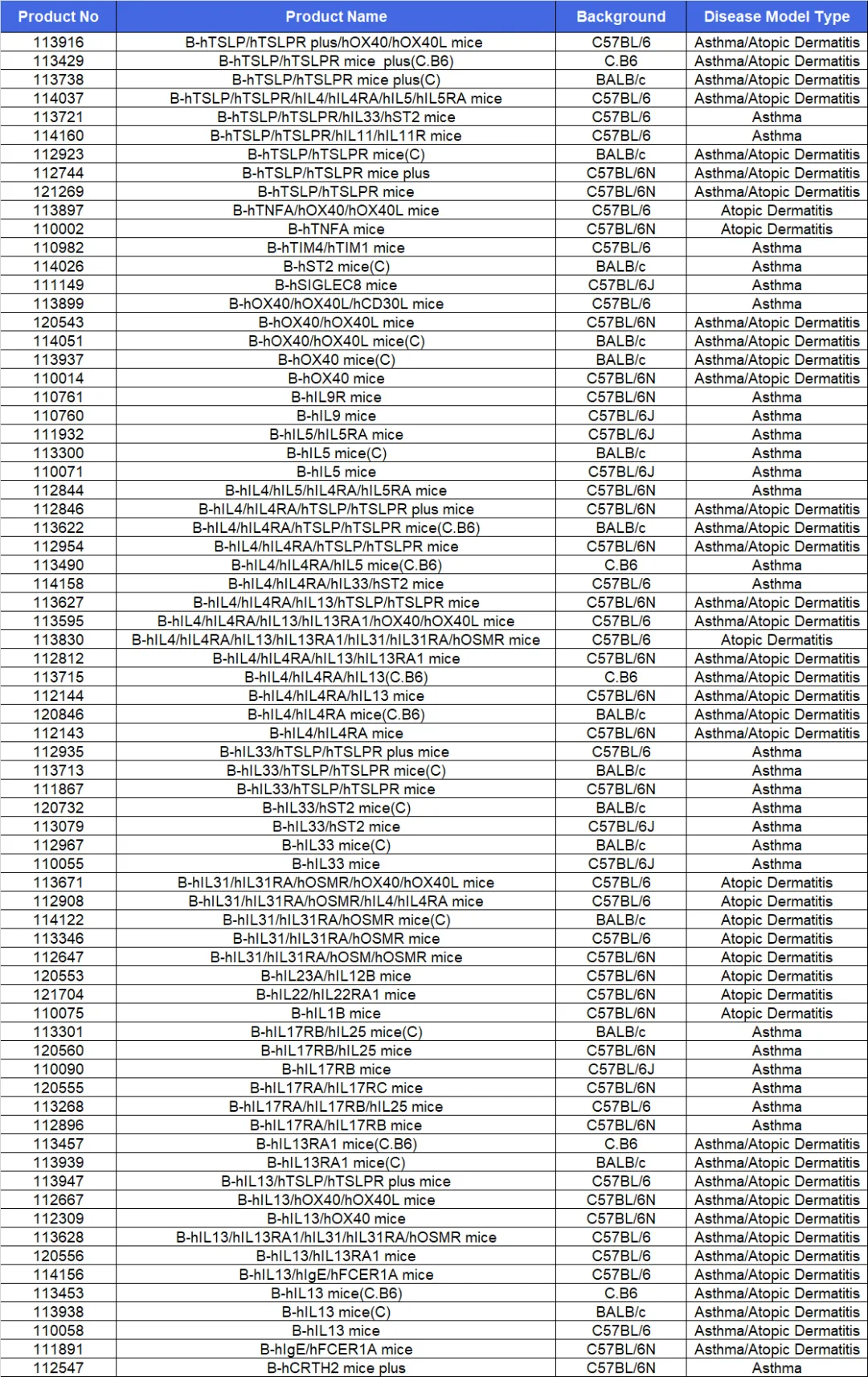
表1. 过敏性疾病相关靶点人源化小鼠
过敏无小事,对于过敏,请大家平时多多注意预防。在明确过敏原后,我们应该尽可能地远离过敏原,规避过敏发生的可能。如果出现了过敏反应,也不要慌张,理性应对,及早就医,规范治疗。
参考文献
[1] Zellweger F , Eggel A . IgE‐associated allergic disorders: recent advances in etiology, diagnosis, and treatment[J]. Allergy, 2016, 71(12).
[2] 曹雪涛 医学免疫学(第9版) 人民卫生出版社
[3] Pullen N A , Falanga Y T , Morales J K , et al. The Fyn-STAT5 Pathway: A New Frontier in IgE- and IgG-Mediated Mast Cell Signaling[J]. Frontiers in Immunology, 2012, 3
[4] Gandhi, Namita A., et al. Nature Reviews Drug Discovery .2016
[5] Varricchi, G., et al., Thymic Stromal Lymphopoietin Isoforms, Inflammatory Disorders, and Cancer. Front Immunol, 2018. 9: p. 1595.
[6] León B, Ballesteros-Tato A. Modulating Th2 Cell Immunity for the Treatment of Asthma. Front Immunol. 2021;12:637948. Published 2021 Feb 10.