이 페이지에서
약물의 효능과 안전성에 대한 기계적 및 기능적 데이터는 IND 신청 성공에 필수적입니다. 당사의 과학자들은 귀하의 약물 개발 과정에서 특정 요구 사항을 충족시키기 위해 맞춤형 전문 연구 설계를 제공합니다.
약효학 (PD) 서비스는 다음을 포함합니다:
약리학 (PK) 서비스는 다음을 포함합니다:







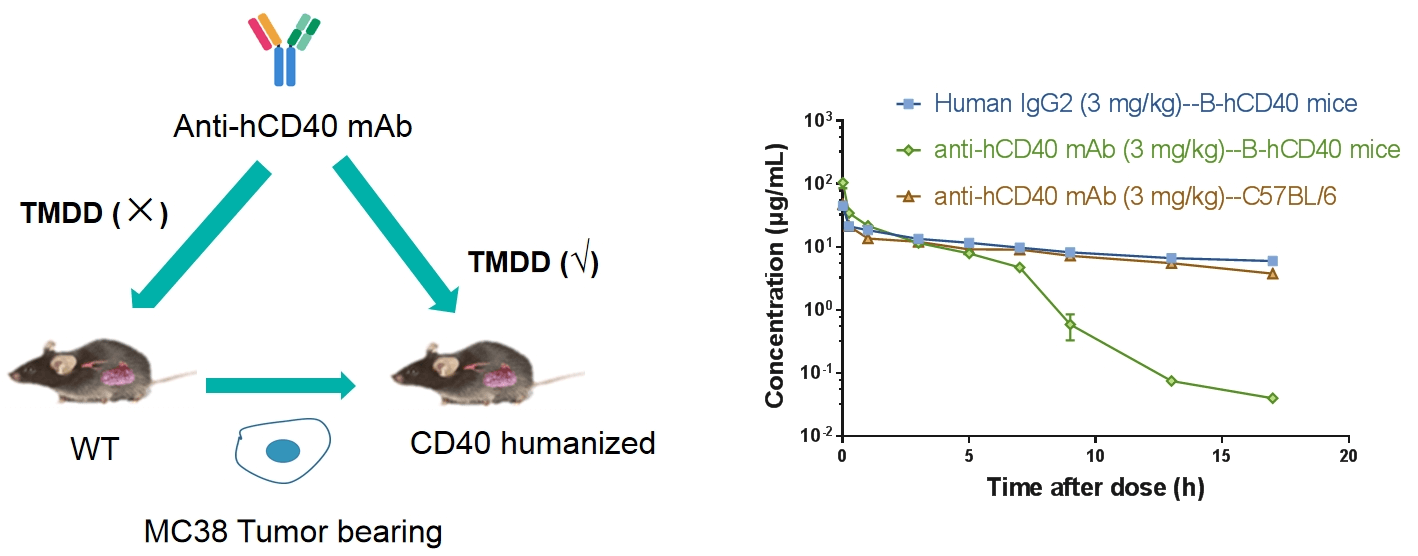
수용체 점유율(RO)은 항체 약물 개발에서 중요한 약리학적 지표입니다. RO 분석은 주어진 용량 하에서 특정 세포에서 테스트 물질이 타겟에 결합하는 것을 여러 시간 지점에서 평가합니다. RO 데이터를 약리학적 데이터 및 유효성 데이터와 결합하여 연구자는 용량-반응 관계를 더 잘 이해할 수 있습니다. 유세포 분석은 경쟁 항체, 비경쟁 항체 및 항약물 형광 2차 항체를 사용하여 수용체 점유율 연구를 수행하는 주요 방법입니다. 다양한 검출 조건을 검토하여 자유 수용체, 결합된 수용체 및 전체 수용체의 신호를 측정하고 수용체 점유율을 정확하게 계산할 수 있습니다.
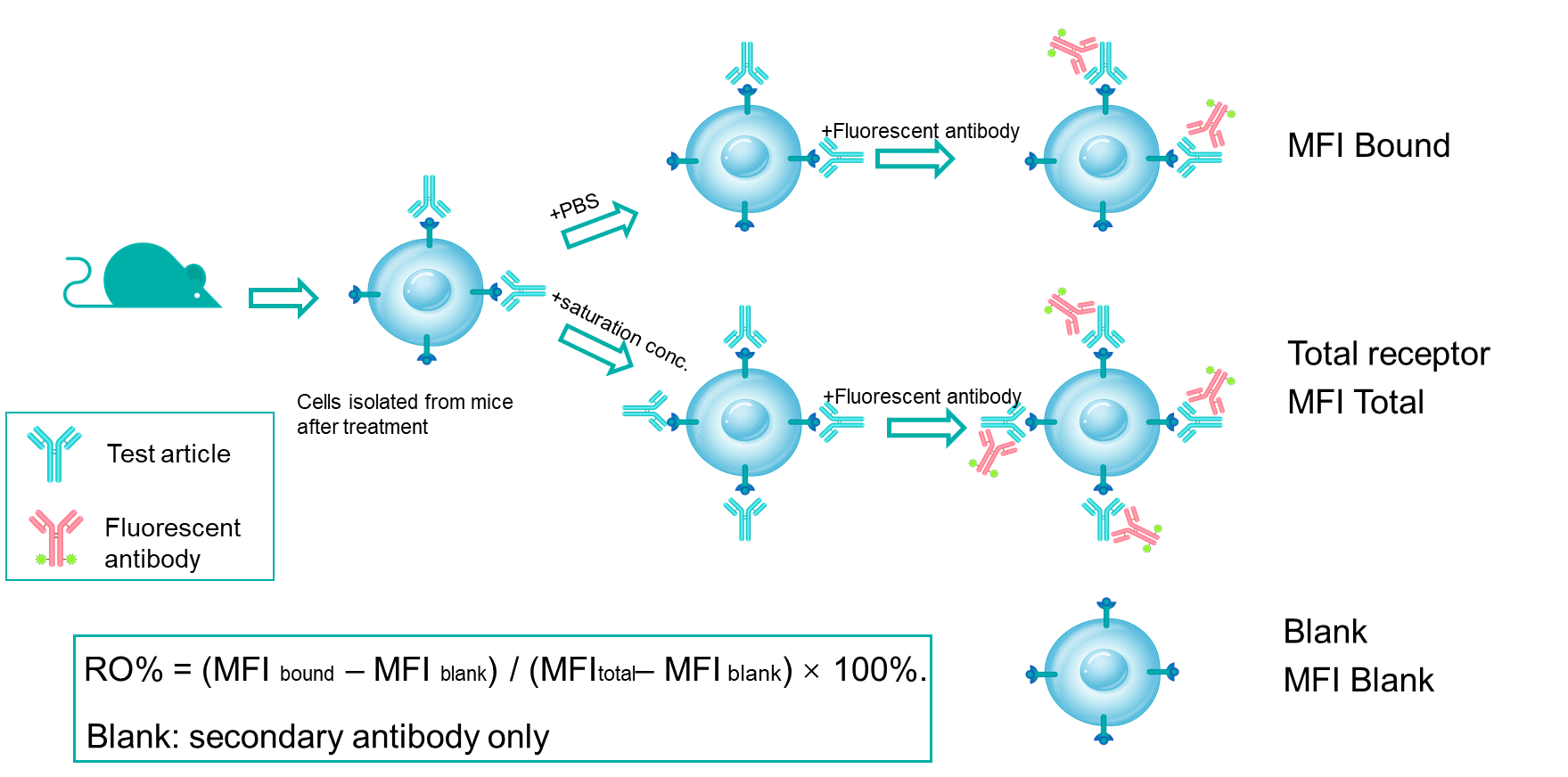
RO% 분석 메커니즘
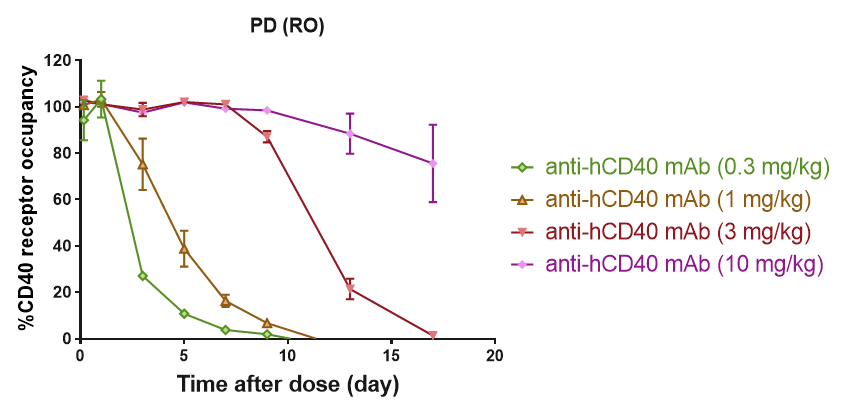
B-hCD40 마우스 말초혈액 CD19+ B 세포에서 CD40 항체의 수용체 점유율 분석. 인간화된 B-hCD40 마우스는 서로 다른 용량의 항인간 CD40 항체로 치료되고, 말초혈액 B 세포에서 수용체 점유율 백분율이 유세포 분석으로 평가되었습니다.
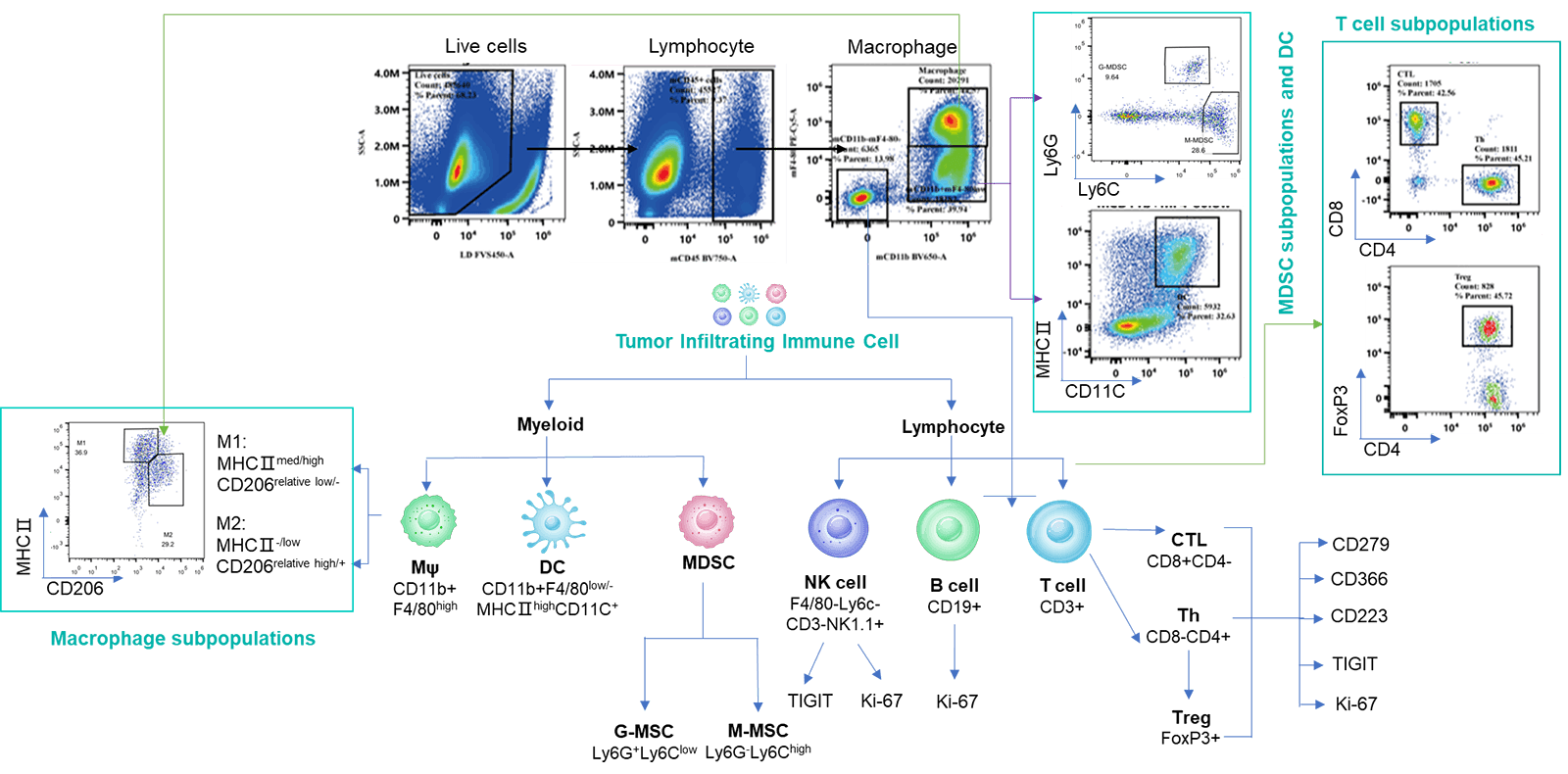
종양 침윤 면역 세포 분석은 약물이 종양 면역 미세환경에 미치는 조절 효과를 이해하는 데 필수적입니다. 다중 파라미터 유세포 분석을 통해 우리는 종양 내에서 다양한 면역 세포 하위 집단의 침윤 수준과 활성화 또는 억제 상태를 종합적으로 평가할 수 있습니다. 더 자세한 통찰을 얻기 위해 다중 면역 형광 및 면역조직화학(IHC) 연구를 활용하여 종양 조직 절편 내에서 면역 세포 침윤과 그 공간적 분포를 분석합니다. 이러한 접근 방식은 차별화된 종양 면역 치료제의 작용 메커니즘을 설명하는 데 중요한 데이터를 제공합니다.
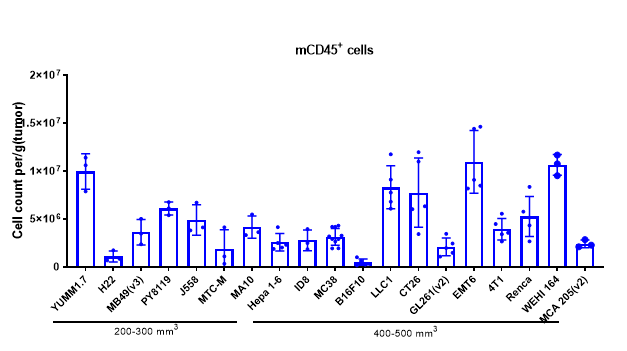
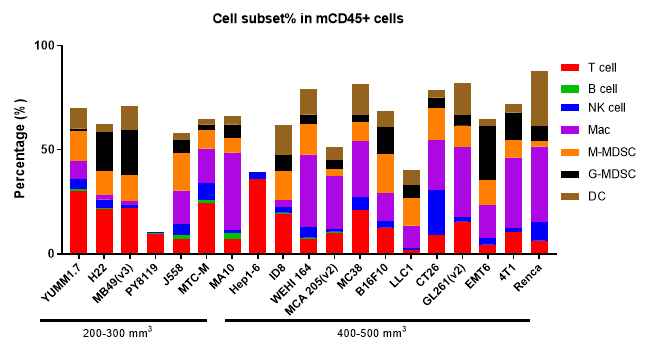
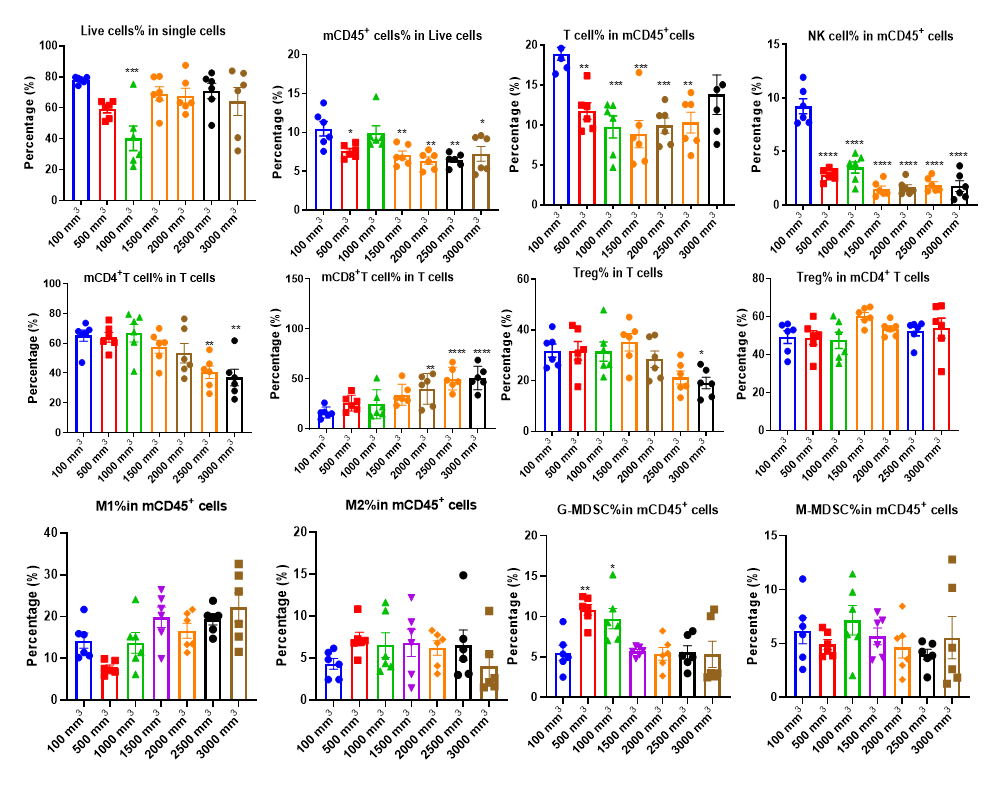
다양한 크기의 MC38 종양에서 여러 면역 세포의 침윤 데이터는 Mean±SEM으로 표시되며, One-way ANOVA를 사용하여 분석되어 100 mm3와 비교됩니다.
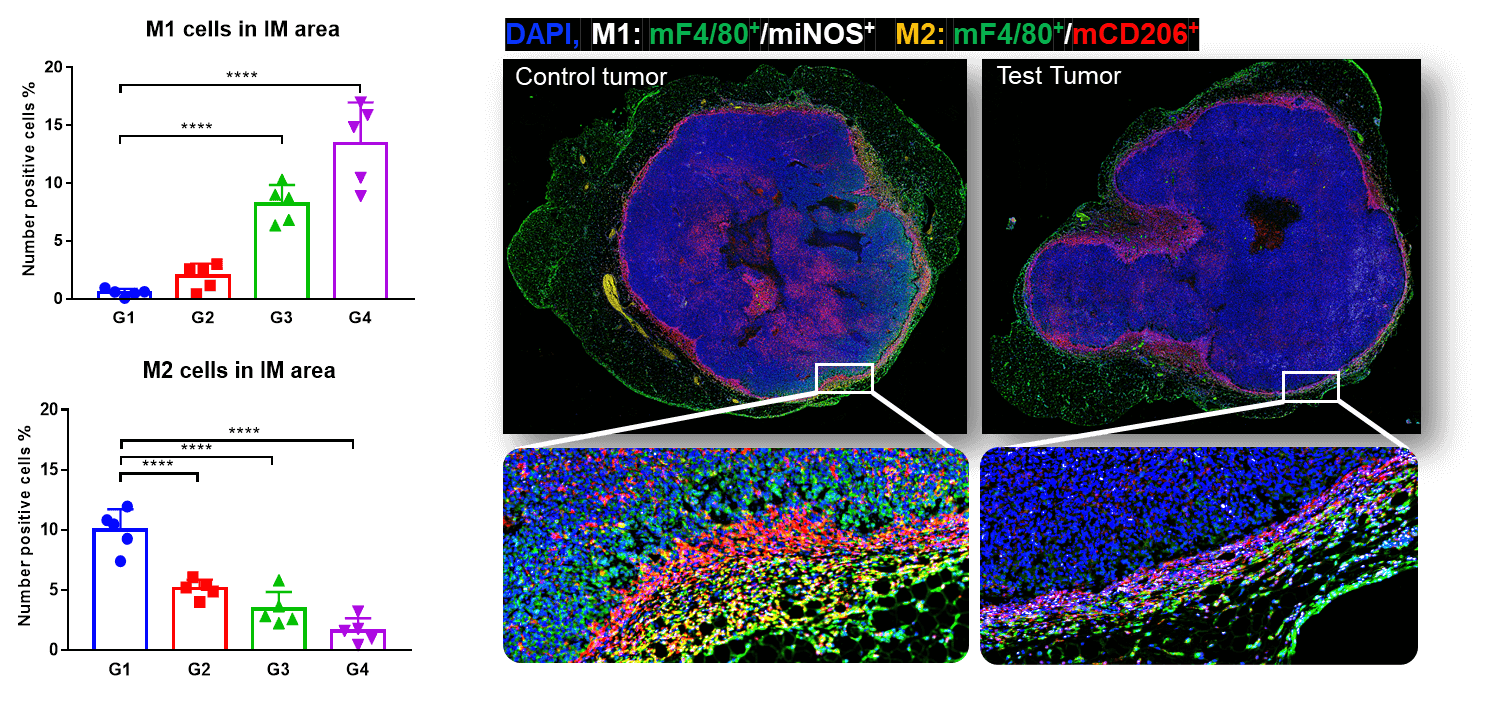
종양 조직의 4중 면역 형광 전체 슬라이드 스캔 및 침습 가장자리에서 M1과 M2의 공동 위치. MC38 종양의 침습 가장자리에서는 M1이 증가하고, 펨브롤리주맙 치료에 의해 M2가 유의미하게 감소했습니다. 이는 M1 침윤이 항PD-1에 의한 종양 성장 억제를 촉진했음을 나타냅니다.
TMA 염색은 CD8+ T(CTL) 세포가 Test의 종양 침습 가장자리와 중앙 종양 부위에서 극적으로 증가한 것을 보여줍니다. 이는 M1/M2 비율의 증가와 관련이 있습니다.
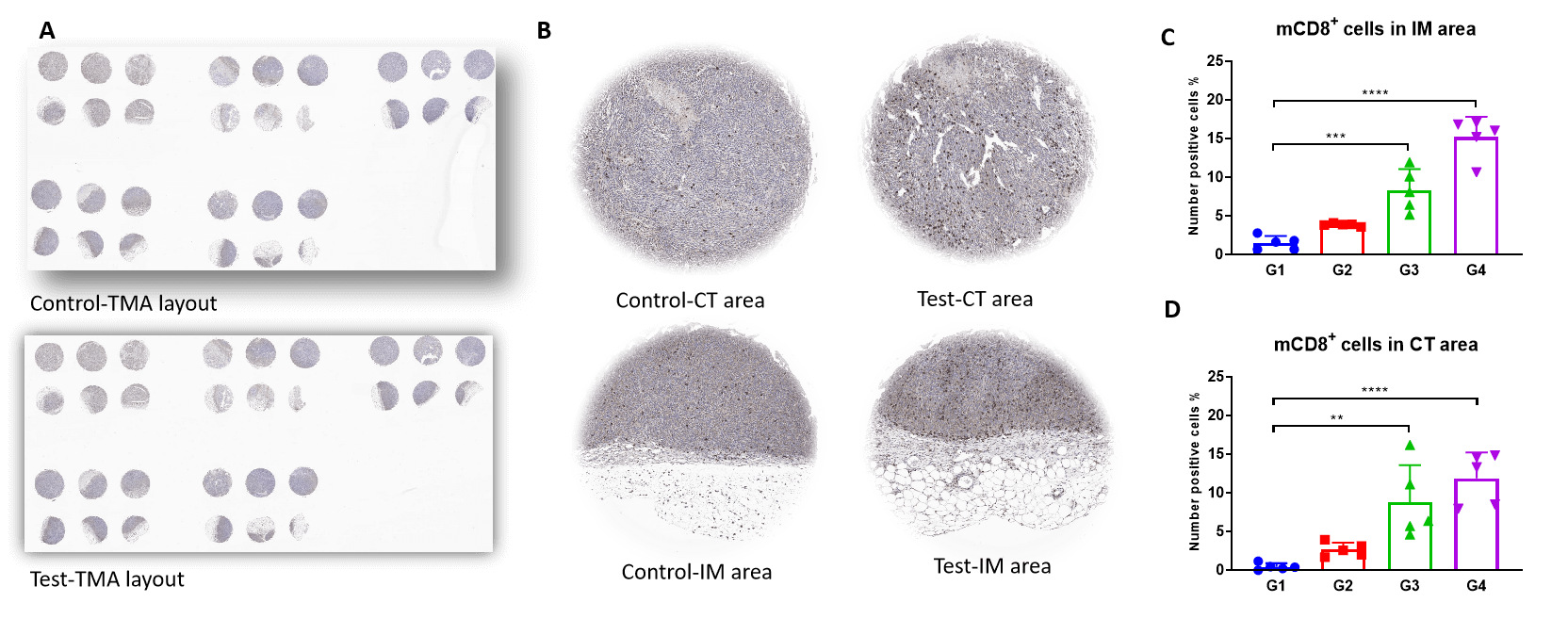
중앙 종양 및 침습 가장자리에서 mCD8+ T 세포의 조직 미세 배열 IHC 염색
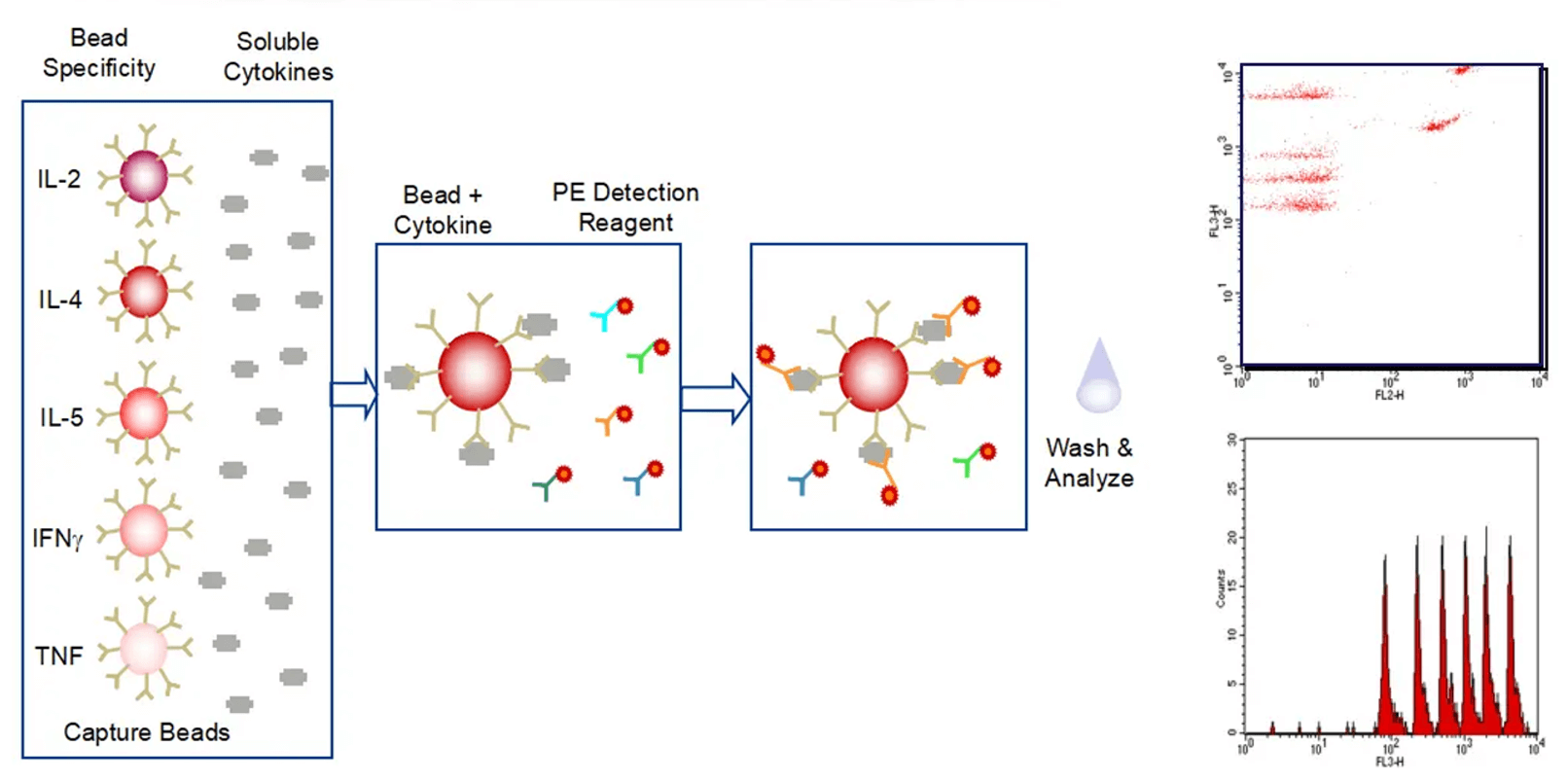
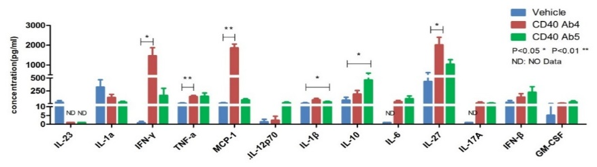
사이토카인 분석은 면역 치료, 면역 관련 질환 및 면역 관련 독성 연구에서 중요한 생체 지표로 작용합니다. 우리는 ELISA, Luminex 및 MSD 플랫폼을 사용하여 세포 배양액, 혈청, 조직 액체 및 조직 균질화 샘플에 대한 단일 또는 다중 사이토카인 분석을 수행합니다. 이는 면역 종양학 및 자가 면역 질환의 약리학적 연구뿐만 아니라 사이토카인 폭풍 연구와 같은 독성학적 연구를 지원합니다.
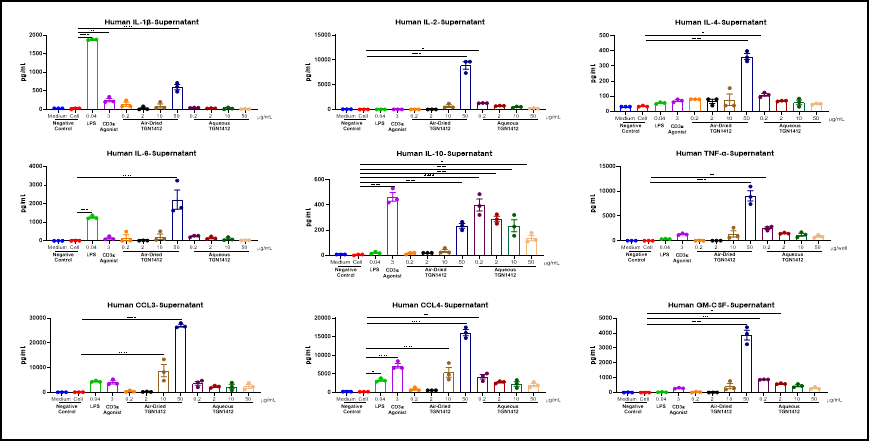
건조된 TGN 1412는 PBMC에서 염증 인자 폭풍을 유도할 수 있습니다 in vitro
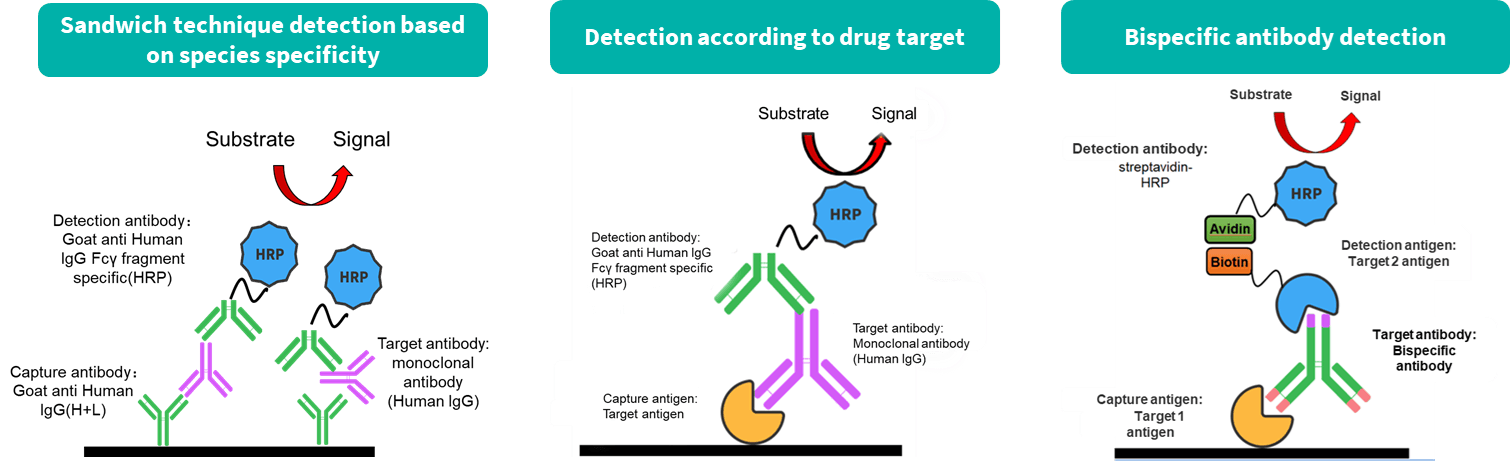
Biocytogen은 전임상 약리학 (PK) 테스트 및 생체 분석에서 광범위한 경험을 제공하며, 항체 약물에 대한 전문적인 PK 분석 서비스를 제공합니다. 우리의 PK 생체 분석 플랫폼은 ELISA 및 전기화학발광(ECL) 기법을 포함합니다.
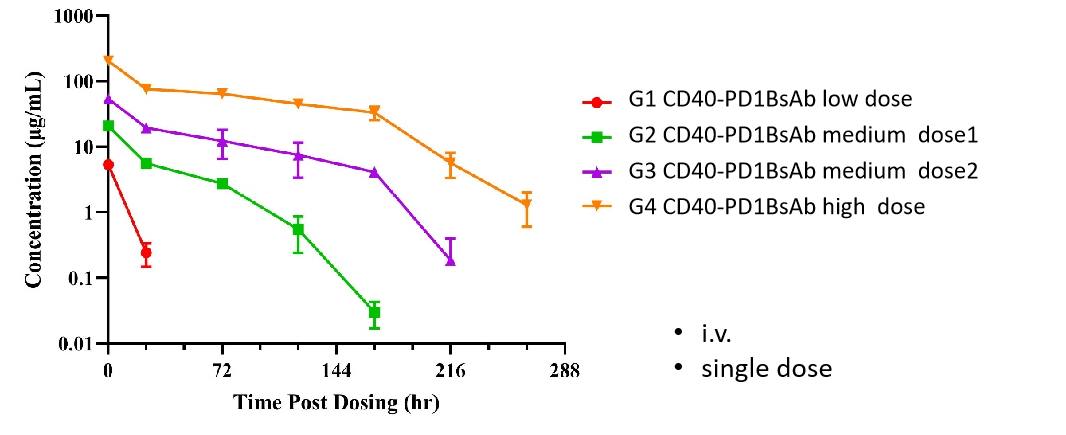
항체 약리학 연구는 전통적인 화학 약물 연구와 다르지만, 여전히 고전적인 약리학 방법에 의존합니다. 그러나 항체 특성에 의해 영향을 받는 약리학적 속성 및 표적화에 더 큰 주의를 기울입니다. 우리는 두 가지 실험 서비스 유형을 제공합니다: 항체 혈청/플라즈마 농도 측정 및 항약물 항체(ADA) 스크리닝.
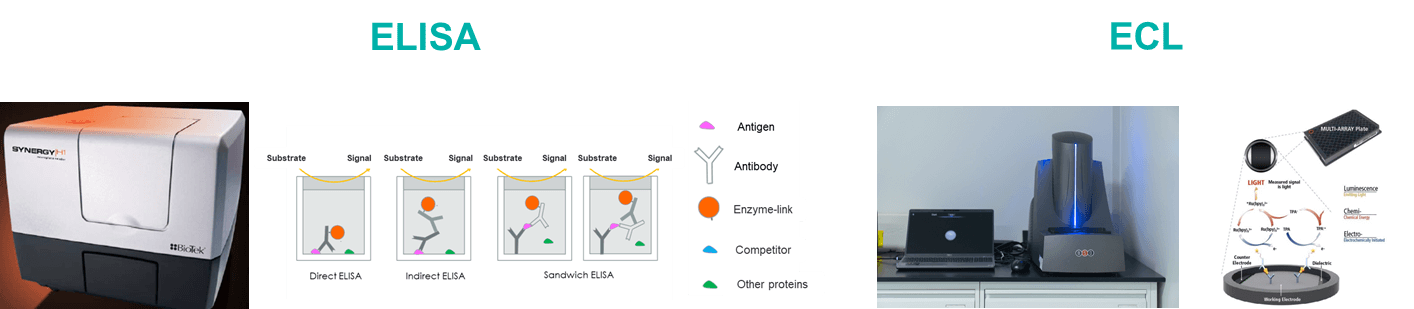
| ELISA | ECL | |
| Plates | Ordinary microporous plate | Graphite electrode microplate |
| Reaction Principle | Catalytic substrate luminescence after antigen antibody binding | Electrochemiluminescence after antibody antigen binding |
| Instrument | BioTek H1/EPOCH2 microplate reader | MSD |
| Advantage | Low cost; High flux; More experience | High sensitivity; High flux; Multi-factor detection; Low sample volume |
| Dynamic range | 2-3 logs | 3-5 logs |
| Purpose | Bioanalytical method validation; Quantitative detection; ADA | |
| Sample Type | Serum or plasma of mice, rats, dogs, monkeys, human, etc; Tumor; Brain tissue; Cerebrospinal fluid. | |
| Drug Type | Monoclonal antibody, Bispecific antibody, ADC, Fusion protein, etc. | |
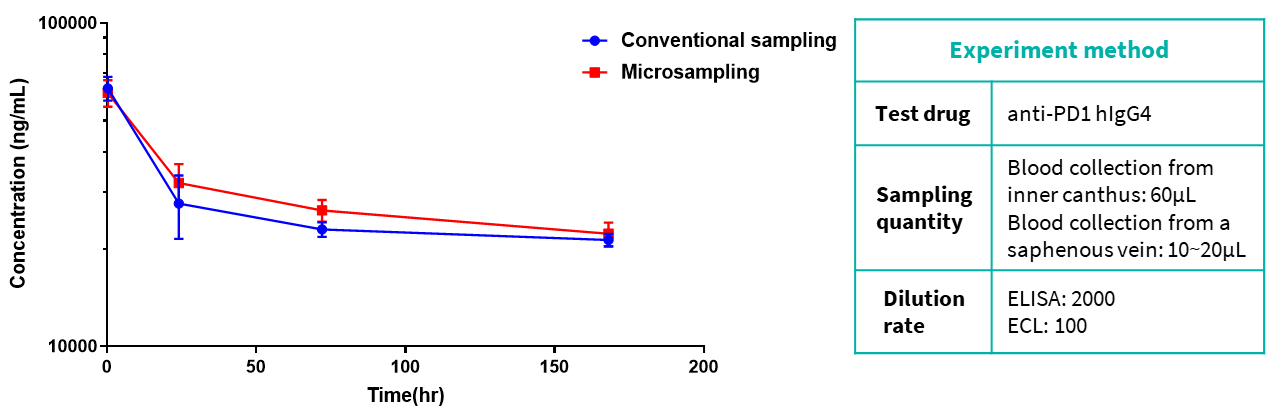
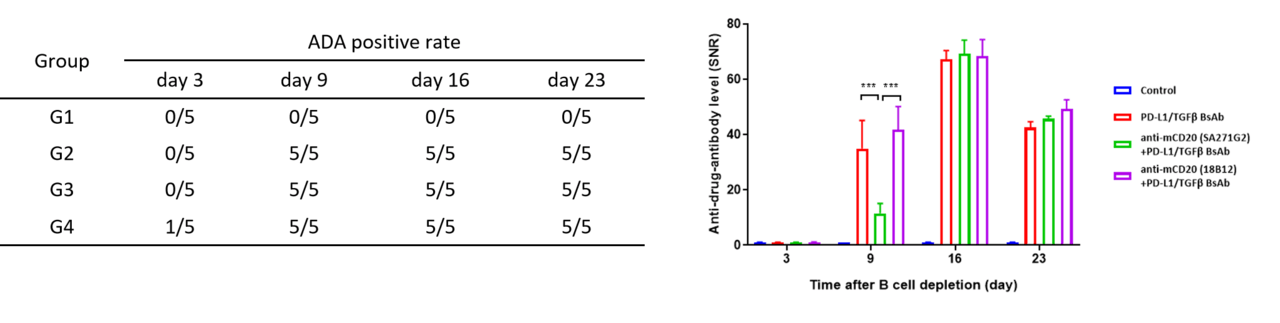
데이터는 두 샘플링 방법의 실험 결과에 뚜렷한 차이가 없음을 보여줍니다.
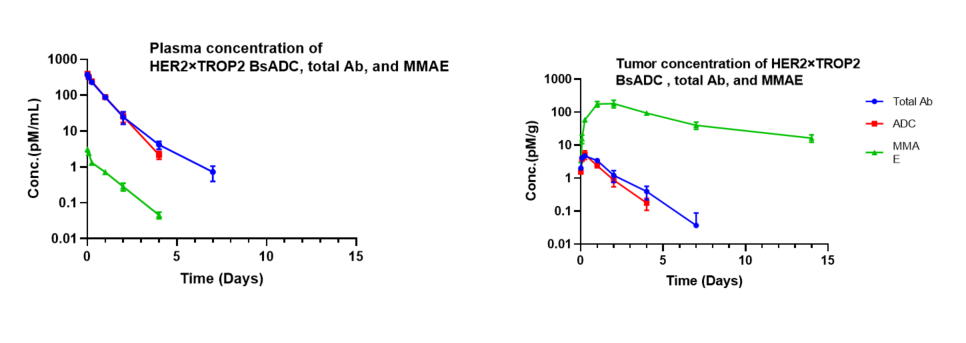
NCI-H1975 이식모델에서 HER2×TROP2 BsADC의 약리학적 분석. HER2×TROP2 BsADC를 3mg/kg 단일 용량으로 투여한 후, MMAE는 종양에 축적되었으나 혈장에는 낮은 수준으로 존재했습니다. 이는 HER2×TROP2 BsADC가 MMAE의 효율적인 종양 표적 전달을 달성했음을 시사하며, 더 나은 항종양 활성 가능성이 있음을 나타냅니다.
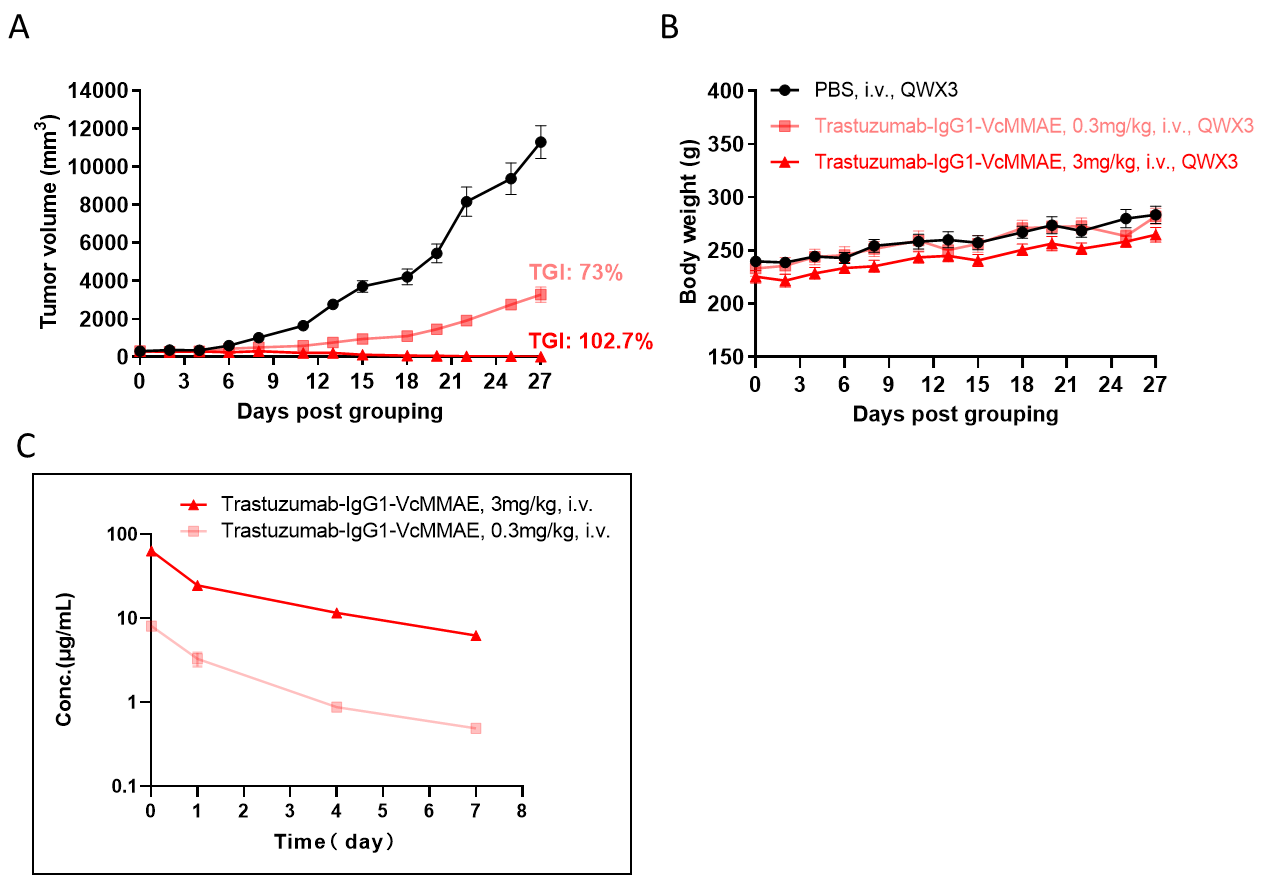
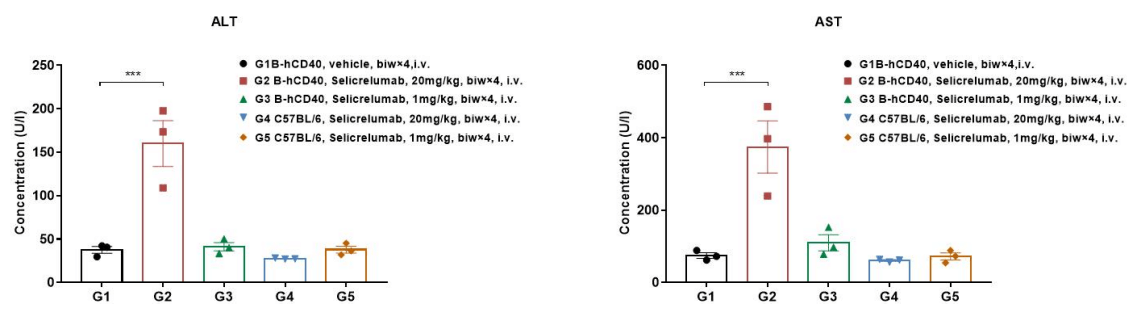
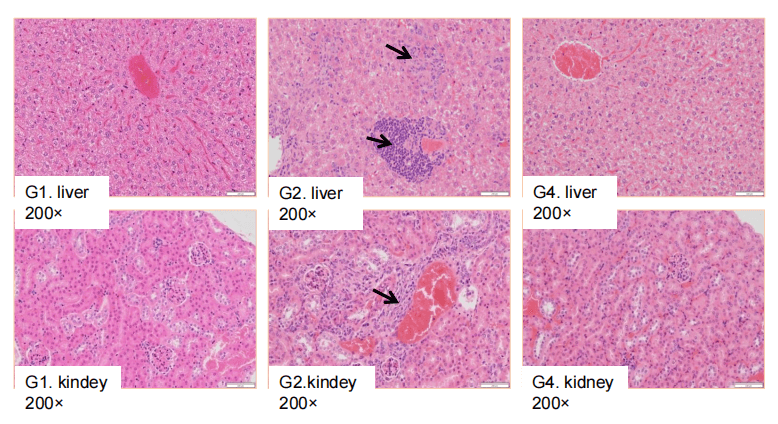
B-SDG 랫에서 ADC의 항종양 활성. (A) ADC(Trastuzumab-IgG1-VcMMAE)는 B-SDG 랫에서 NCI-H1975 종양 성장을 억제했습니다. 인간 비소세포 폐암 세포(5E6)를 B-SDG 랫에 피하 이식한 후 (여성, 8주령, n=6). 종양 부피가 약 300-400 mm3에 도달하면 랫을 그룹화하고, 해당 시점에서 ADC를 패널에 표시된 용량으로 치료했습니다. (B) 치료 중 체중 변화. (C) 마지막 치료 후 ADC의 PK 시험. 패널 A에서 보듯이, ADC는 B-SDG 랫에서 종양 성장 억제에 효과적이었으며, B-SDG 랫이 ADC의 생체 내 평가를 위한 강력한 전임상 모델을 제공함을 보여줍니다. 값은 평균 ± SEM으로 표현됩니다.
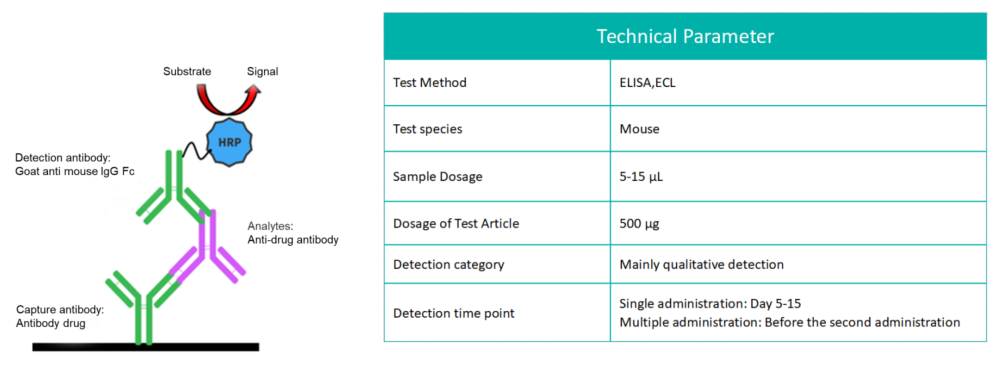
생물학적 제제를 사용한 치료 중 일부 유기체는 면역 반응을 일으킬 수 있으며, 그 중 가장 두드러진 반응은 항약물 항체(ADA)의 생성입니다. 면역원성은 물질이 면역 반응을 유발하는 능력을 의미합니다. ADA-단클론항체(mAb) 면역 복합체의 형성은 단클론항체의 추가적인 제거 경로로 작용하여 치료 효과와 체내 제거에 중요한 영향을 미칩니다.
일반적으로 사용되는 ADA 탐지 방법은 ADA와 약물의 특정 결합 특성을 이용하여 마우스에서 생성된 ADA(본질적으로 마우스 항인간 IgG)를 검출합니다.