이 페이지에서
암 항원은 환자에서 얻은 종양 세포, 종양 관련 단백질 또는 펩타이드, 종양 항원을 발현하는 유전자 등 다양한 형태로 인위적으로 합성되어 아쥬번트와 결합되거나, 수지상 세포를 전달 캐리어로 사용하여 백신으로 조제됩니다. 백신이 체내에 들어가면, 종양 항원은 수지상 세포(DC)에 의해 포획되어 그 후 처리되고 T세포에 제시되어 항원 특이적인 세포 독성 T세포가 활성화되어 종양을 공격합니다. 가장 이상적인 종양 특이적 항원은 종양 세포의 유전자 변이에 의해 생성되어 정상 조직에서는 발현되지 않는 네오 항원입니다. 그것은 세포 표면에 제시되어 MHC 분자에 결합한 후, T세포에 의해 인식됩니다.
백신은 순수히 예방적 수단에서 치료적 응용으로 진화하고 있으며, 전통적인 단백질 및 펩타이드 백신에서 첨단 mRNA 백신에 이르기까지 다양한 종류가 있습니다. Biocytogen은 HLA 인간화 마우스 및 HLA 인간화 종양 세포주를 기반으로 다양한 면역원성 평가 및 종양 효과 모델을 개발했습니다. 이러한 모델은 마우스 항원 제시 세포(APC)가 인간과 동일하거나 동일한 펩타이드 에피토프를 제시하고 인식할 수 있게 하여 암 백신 개발을 가속화합니다. 또한 면역원성, 효과, 작용 기전, 안전성에 대한 종합적인 평가를 수행하기 위한 최첨단 in vivo 및 in vitro 플랫폼도 구축되었습니다.
| Immunogenicity validation | Efficacy validation | MOA exploration |
|
|
|
백신 평가를 위한 동물 모델:
동종 모델:
이식 모델:
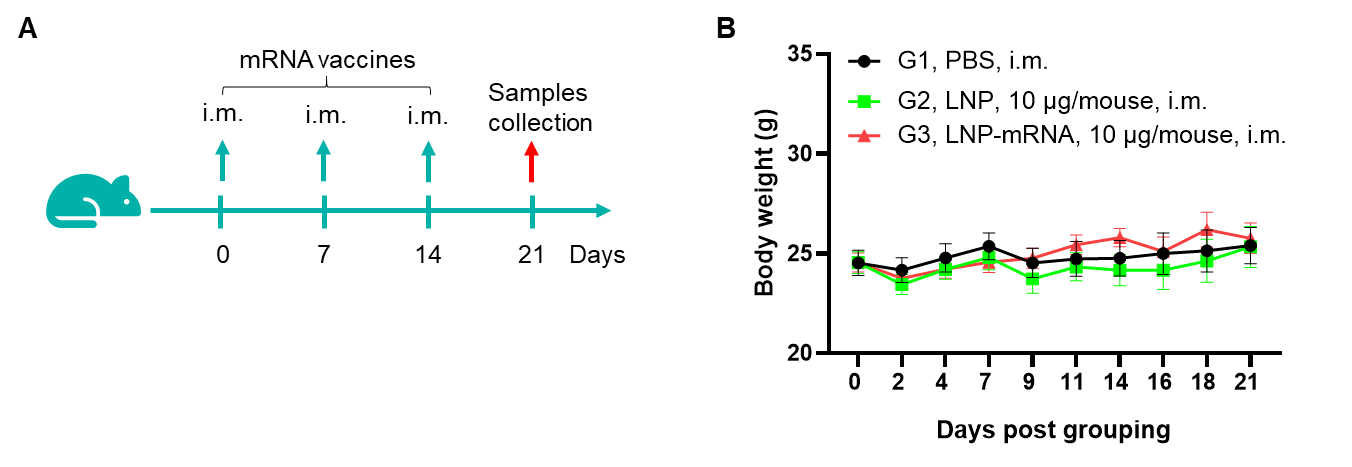
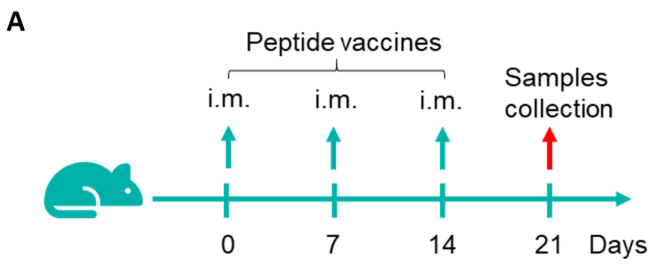
그림 1. B-HLA-A2.1 마우스에서 mRNA 백신 유도 면역 반응의 검출 68주령의 암컷 B-HLA-A2.1 마우스를 PBS군과 mRNA 백신군(각 군 n = 6)으로 나누어 양쪽 다리 근육에 PBS 또는 백신을 접종했습니다. 마지막 면역 후 1주일에 마우스를 안락사시키고 비장 세포를 채취하여 각 펩타이드나 관련 없는 펩티드를(음성 대조군(NC)) 자극한 후 IFN-γ 분비와 항원 특이적 T세포를 측정했습니다. (A) 실험 계획. (B) 군 간에 체중에 유의미한 차이 없음. 값은 평균 ± SEM으로 나타냄.
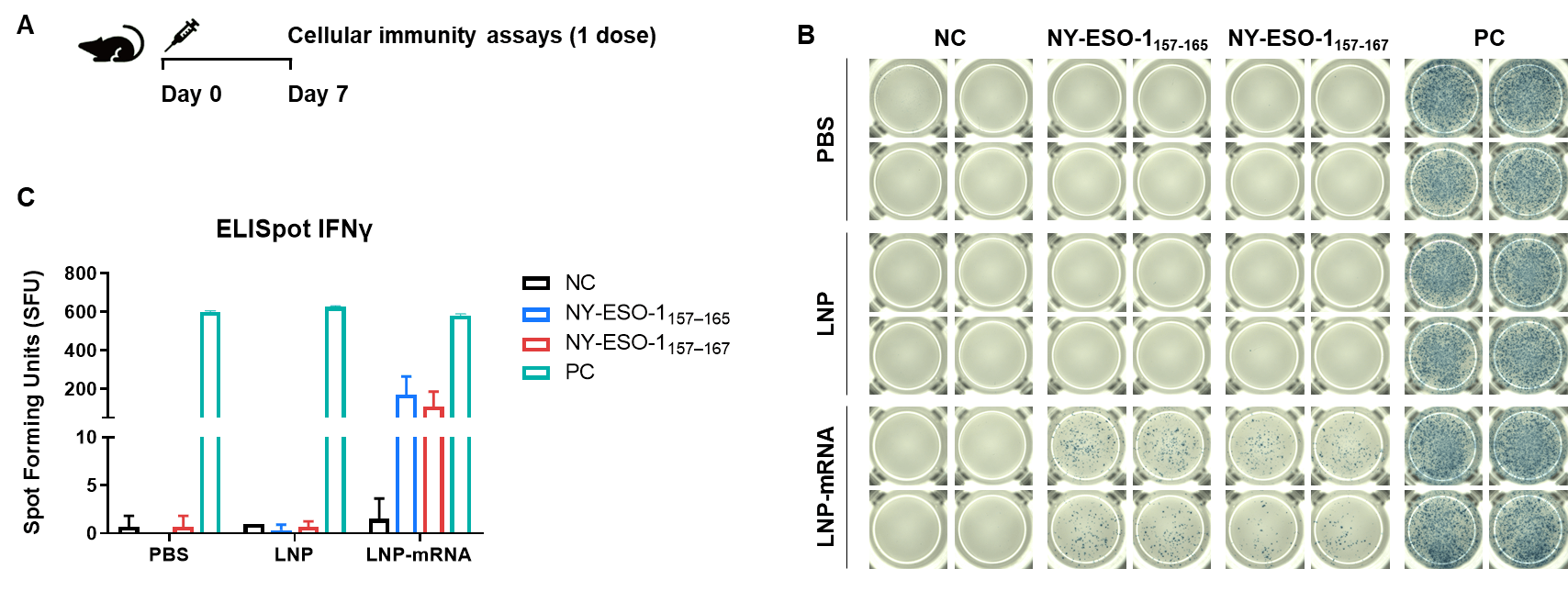
그림 2. IFN-γ ELISpot 분석을 통한 B-HLA-A2.1 마우스에서 mRNA 백신 유도 면역 반응의 검출 (A) 백신 접종 및 분석 계획. 910주령의 수컷 B-HLA-A2.1 마우스를 PBS군, LNP군, LNP-mRNA군(각 군 n = 3)으로 나누어 양쪽 다리 근육에 PBS, LNP 또는 LNP-mRNA를 1회 접종했습니다. 면역 후 1주일에 마우스를 안락사시키고 비장 세포를 채취하여 개별 펩타이드로 자극하거나 펩타이드 없이 음성 대조군으로 사용하거나 PMA/Ionomycin을 양성 대조군으로 사용하여 IFN-γ 분비를 측정했습니다. (B) 면역화된 마우스에서 채취한 비장 세포를 사용한 대표적인 결과. (C) 결과의 요약. 값은 평균 ± SEM으로 나타냄. NC: 음성 대조군. PC: 양성 대조군. (실험 번호: 24P037503)

그림 3. IFN-γ ELISpot 분석을 통한 B-HLA-A2.1 마우스에서 mRNA 백신 유도 면역 반응의 검출 (A) 백신 접종 및 분석 계획. 9~10주령의 수컷 B-HLA-A2.1 마우스를 PBS군, LNP군, LNP-mRNA군(각 군 n = 3)으로 나누어 양쪽 다리 근육에 PBS, LNP 또는 LNP-mRNA를 3회 접종했습니다. 마지막 면역 후 1주일에 마우스를 안락사시키고 비장 세포를 채취하여 개별 펩타이드로 자극하거나 펩타이드 없이 음성 대조군으로 사용하거나 PMA/Ionomycin을 양성 대조군으로 사용하여 IFN-γ 분비를 측정했습니다. (B) 면역화된 마우스에서 채취한 비장 세포를 사용한 대표적인 결과. (C) 결과의 요약. 값은 평균 ± SEM으로 나타냄. NC: 음성 대조군. PC: 양성 대조군. (실험 번호: 24P037503)
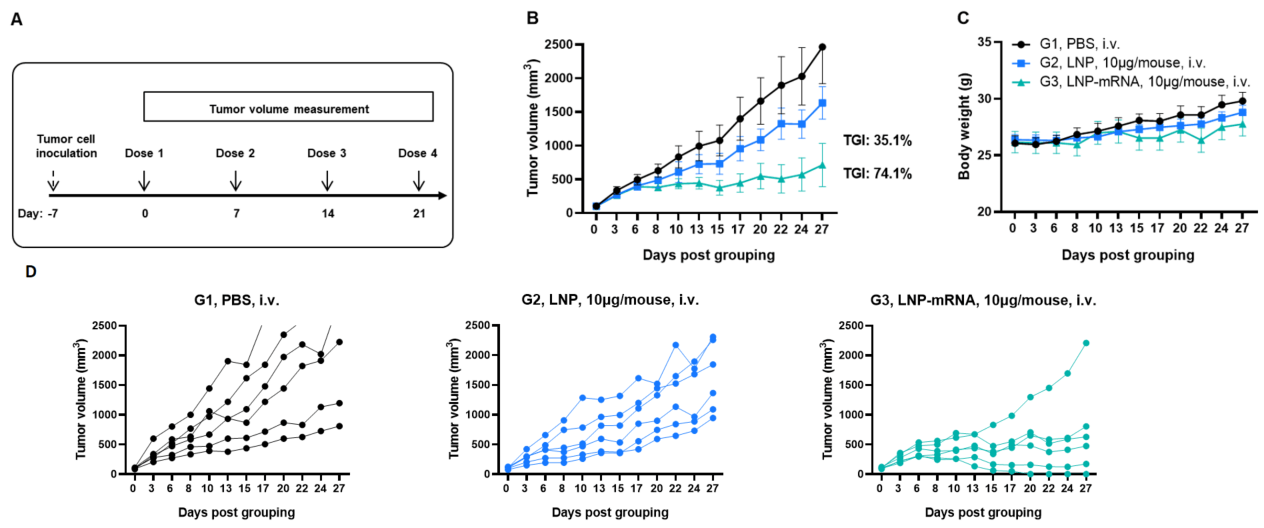
그림 1. 동종 종양에 대한 LNP-mRNA의 항종양 활성 (A) 실험 계획. (B) LNP 또는 LNP-mRNA 치료에 의한 항종양 활성. B-HLA-A2.1 마우스(n = 6/군)는 PBS, LNP 또는 LNP-mRNA(10 μg/마우스)로 백신 접종되었습니다. B-HLA-A2.1/hNY-ESO-1 MC38 세포는 마우스의 오른쪽 복부에 접종되었습니다. (C) 치료 중 체중 변화. 그림 B에 나타낸 대로 LNP-mRNA는 B-HLA-A2.1 마우스에서 종양 성장을 제어하는 데 효과적이었습니다. (D) 개별 마우스에서의 B-HLA-A2.1/hNY-ESO-1 MC38 종양 세포 성장. 값은 평균 ± SEM으로 나타냄. (실험 번호: 24P037502)
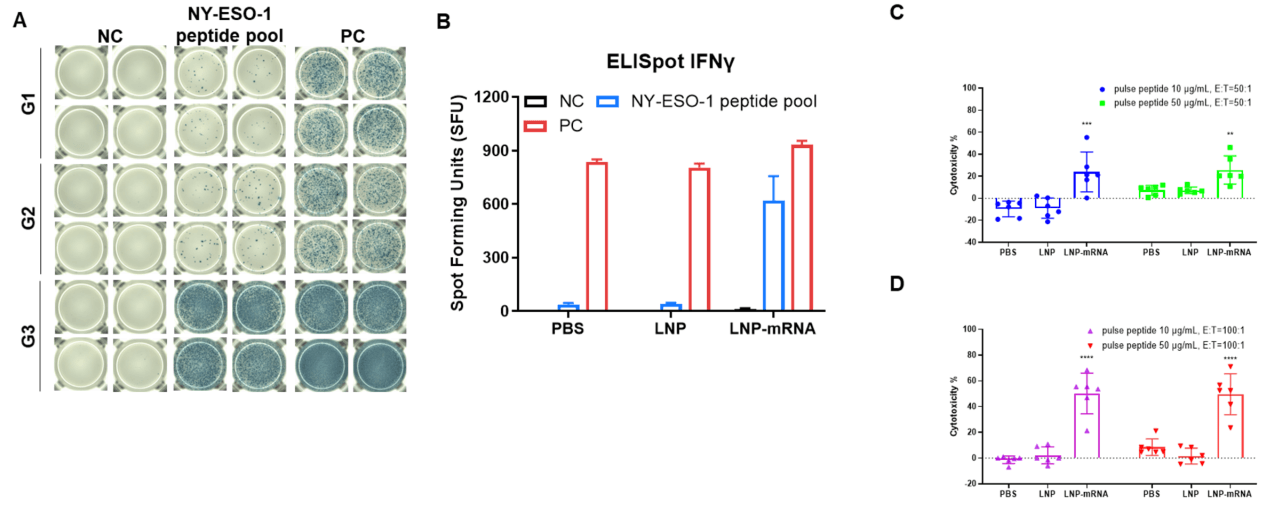
그림 2. (A 및 B) IFN-γ ELISpot 분석을 통한 B-HLA-A2.1 마우스에서의 백신 유도 면역 반응의 검출. NC: 음성 대조군. PC: 양성 대조군. (C 및 D) B-HLA-A2.1 마우스에서 분리한 CTL의 NY-ESO-1 펩타이드에 대한 세포 독성 검사. NY-ESO-1 펩타이드로 자극된 B-HLA-A2.1/hNY-ESO-1 MC38 세포에 대한 CTL의 세포 독성 활성은 LDH 방출 분석에서 에페크터-타겟 비율 50:1 또는 100:1에서 2개의 다른 펩타이드 농도(10μg 또는 50μg)로 측정되었습니다. 값은 평균 ± SEM으로 나타냄. 통계 분석은 PBS군과 비교하여 각 치료군을 일원배치 분산 분석(ANOVA) 및 다네트의 다중 비교 검정을 사용하여 수행했습니다. **p<0.01, ***p<0.001, ****p<0.0001.
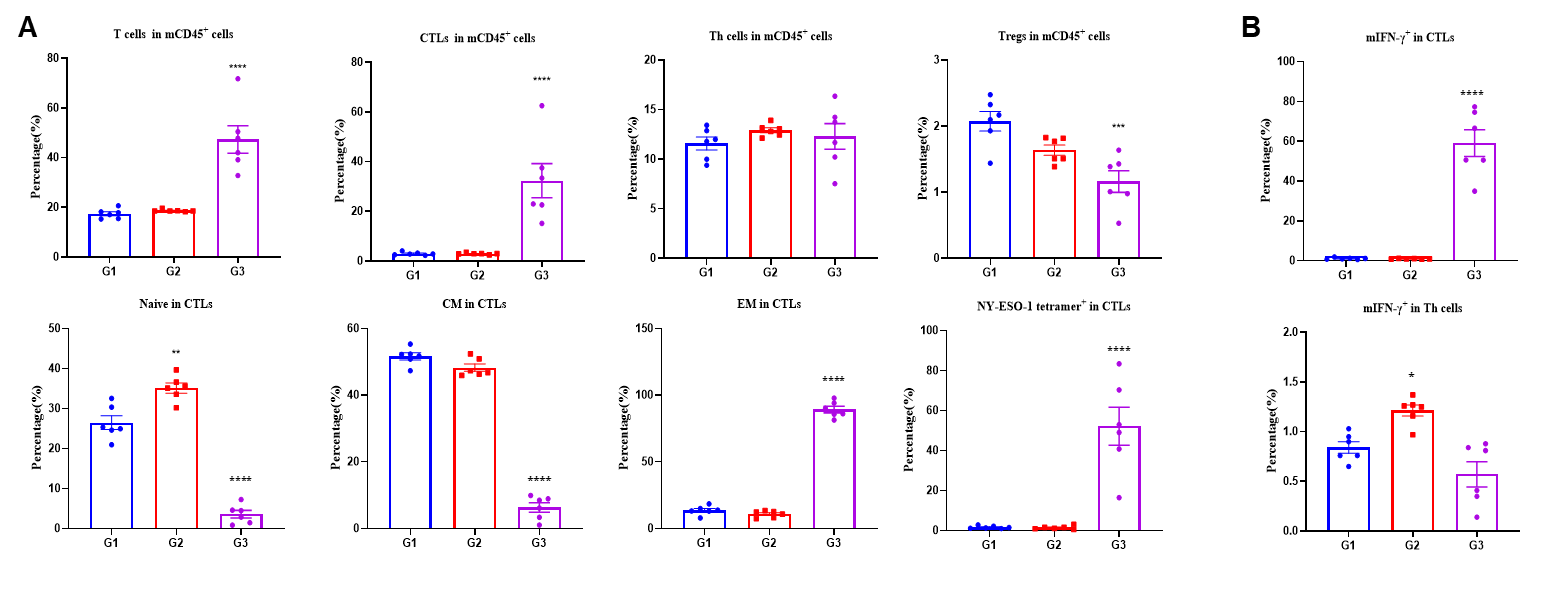
그림 3. 백신 접종에 의해 비장에서 특이적인 효과기 CD8+T세포가 생성됨 PBS, LNP, LNP-mRNA 백신으로 면역화된 B-HLA-A2.1/hNY-ESO-1 MC38 종양을 가진 마우스의 비장에서. (A) 흐름 세포 분석을 통한 비장의 CD8+T, CD4+T, Treg 세포 분석. 비장 T세포 및 CD8+T세포의 비율이 유의미하게 증가했습니다. mRNA 백신은 비장에서 총 CD8+T세포의 약 50%를 테트라마+CD8+T세포로 생성했습니다. CD8+T세포는 미성숙 및 중심 기억에서 빈도가 낮고 주로 효과 기억에 위치해 있었습니다. (B) NY-ESO-1 펩타이드로 자극된 면역화된 마우스에서 분리한 비장 세포의 세포 내 사이토카인 염색. mIFN-γ는 주로 CD8+T세포에서 분비되었고, CD4+T세포에서는 분비되지 않았습니다. 값은 평균 ± SEM으로 나타냄. 통계 분석은 PBS군과 비교하여 각 치료군을 일원배치 분산 분석(ANOVA) 및 다네트의 다중 비교 검정을 사용하여 수행했습니다. *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001.
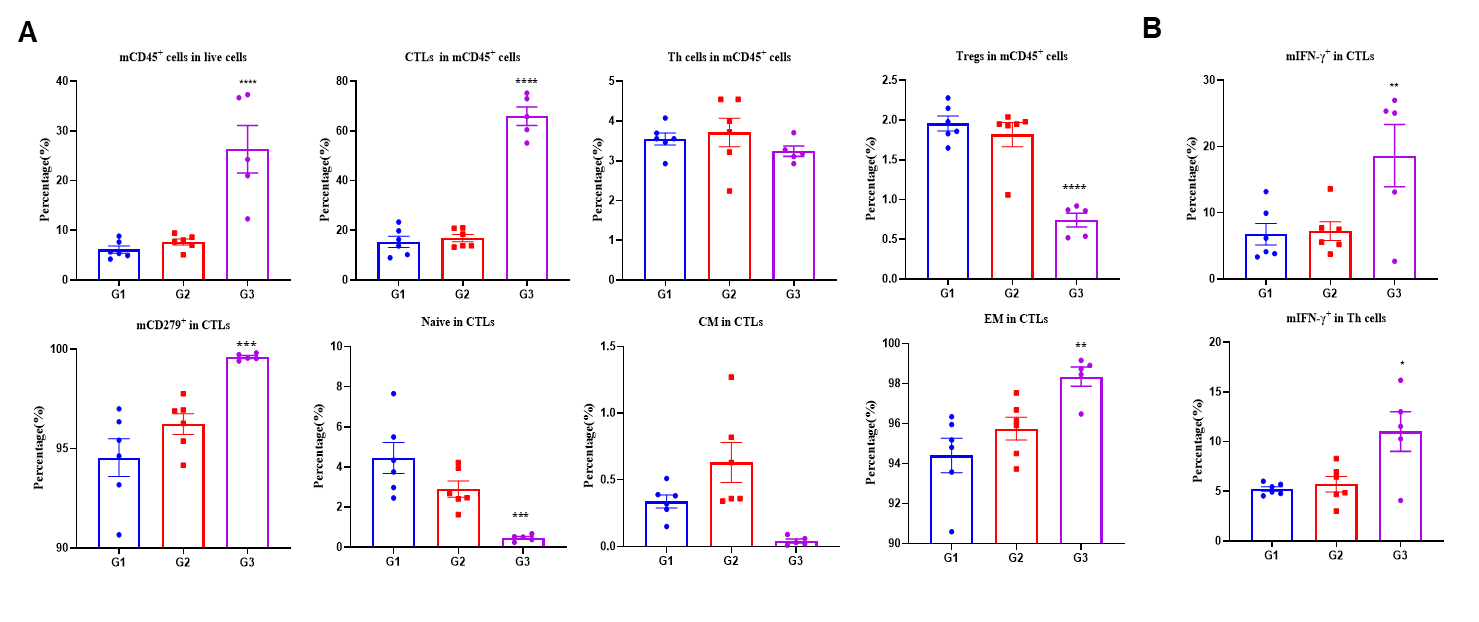
그림 4. LNP-mRNA는 종양에 대한 항종양 T세포의 유익한 레퍼토리를 강화함 PBS, 빈 LNP 또는 LNP-mRNA로 면역화된 B-HLA-A2.1/hNY-ESO-1 MC38 종양을 가진 마우스에서. (A) 흐름 세포 분석을 통한 종양 침윤 T세포 및 CD8+T세포 분석. 종양 침윤 T세포 및 CD8+T세포의 비율이 유의미하게 증가했습니다. 한편, Treg 세포의 빈도는 LNP-mRNA 군에서 유의미하게 감소했습니다. 종양 침윤 CD8+T세포는 미성숙 및 효과 기억(EM) CD8+T세포의 빈도가 유의미하게 증가했습니다. (B) NY-ESO-1 펩타이드로 자극된 면역화된 마우스에서 분리한 종양 침윤 세포(TIL)의 세포 내 사이토카인 염색. mIFN-γ는 CD8+T세포 및 CD4+T세포 모두에서 분비되었습니다. 값은 평균 ± SEM으로 나타냄. 통계 분석은 PBS군과 비교하여 각 치료군을 일원배치 분산 분석(ANOVA) 및 다네트의 다중 비교 검정을 사용하여 수행했습니다. *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001.
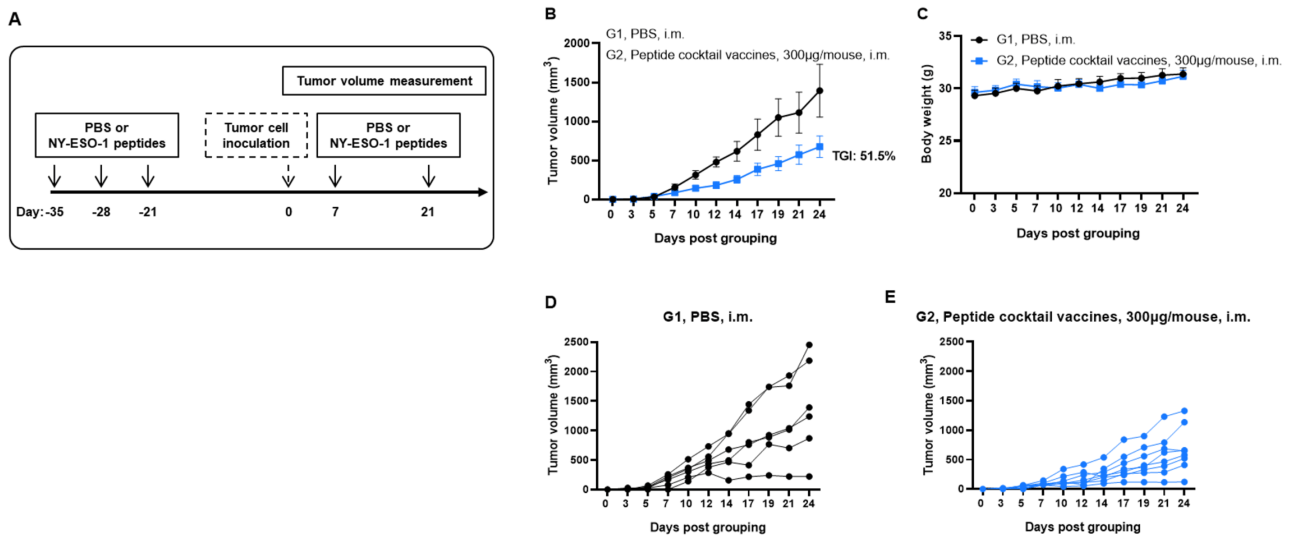
그림 1. 동종 종양에 대한 NY-ESO-1 펩타이드의 항종양 활성 (A) 실험 계획. (B) NY-ESO-1 펩타이드에 의한 예방적 치료에서의 항종양 활성. B-HLA-A2.1 마우스(n = 6 또는 8/군)는 PBS 또는 NY-ESO-1 펩타이드(300 µg)로 백신 접종되었습니다. 마지막 면역 후 3주일에 B-HLA-A2.1/hNY-ESO-1 MC38 세포가 마우스의 오른쪽 복부에 접종되었습니다. (C) 치료 중 체중 변화. 그림 B에 나타낸 대로, NY-ESO-1 펩타이드는 B-HLA-A2.1 마우스에서 종양 성장을 제어하는 데 유효했습니다. (D 및 E) 개별 마우스에서의 종양 성장 곡선. 값은 평균 ± SEM으로 나타냄.
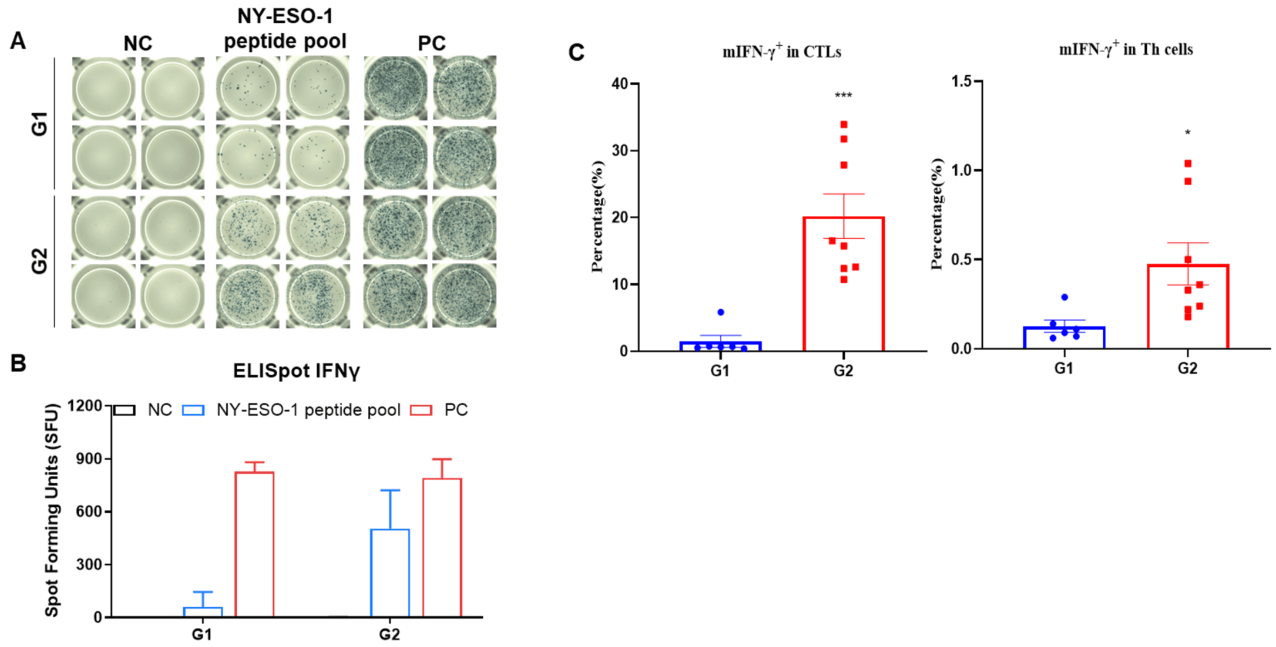
그림 2. (A) 면역화된 마우스에서 채취한 비장 세포로 자극한 대표적 결과. (B) 결과의 요약. (C) mIFN-γ는 주로 CD8+T세포에서 분비되었고, CD4+T세포에서 분비되지 않았습니다. 값은 평균 ± SEM으로 나타냄. 통계적 유의성은 T 검정을 사용하여 결정되었습니다. (*p<0.05, ***p<0.001 vs G1).

그림 3. 백신 펩타이드 백신이 비장 내에서 특이적인 효과기 CD8+ T 세포를 생성. PBS 및 펩타이드 칵테일 백신으로 면역화된 B-HLA-A2.1/hNY-ESO-1 MC38 종양 보유 마우스의 비장에서. 비장의 CD8+ T, CD4+ T 및 Tregs의 분석은 흐름 세포 측정법(Flow Cytometry Assay)으로 수행되었다. 비장 T 세포 및 CD8+ T 세포의 비율(CD45+ 세포 중)은 유의미하게 증가하였다. 펩타이드 백신은 비장에서 CD8+ T 세포의 약 20%에 대해 테트라머+ CD8+ T 세포의 빈도를 생성하였다. CD8+ T 세포는 naive 및 중앙 기억 세포에서 상대적으로 낮은 빈도를 보였으며, 주로 효과기 기억 세포에 국한되었다. 값은 평균 ± SEM으로 표시되었다. 통계적 유의성은 t-검정을 통해 평가되었다. *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001 G1과 비교.
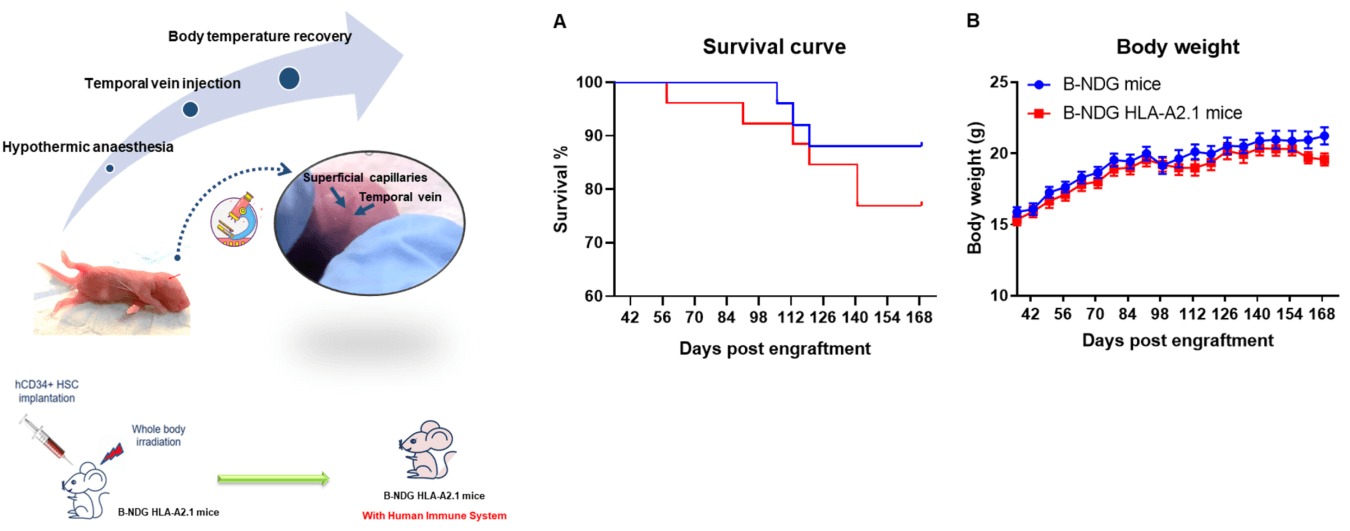
그림 1. 인간 CD34+ HSC가 B-NDG HLA-A2.1 마우스에 정상적으로 정착. 인간 CD34+ HSC는 방사선 조사를 0.8Gy로 수행한 신생아 마우스의 B-NDG HLA-A2.1 마우스와 B-NDG 마우스에 각각 정착하였다. (A) B-NDG HLA-A2.1 마우스는 B-NDG 마우스보다 약간 낮은 생존율을 보였지만 통계적으로 유의미한 차이는 없었다. (B) 체중. 값은 평균 ± SEM으로 표시되었다.
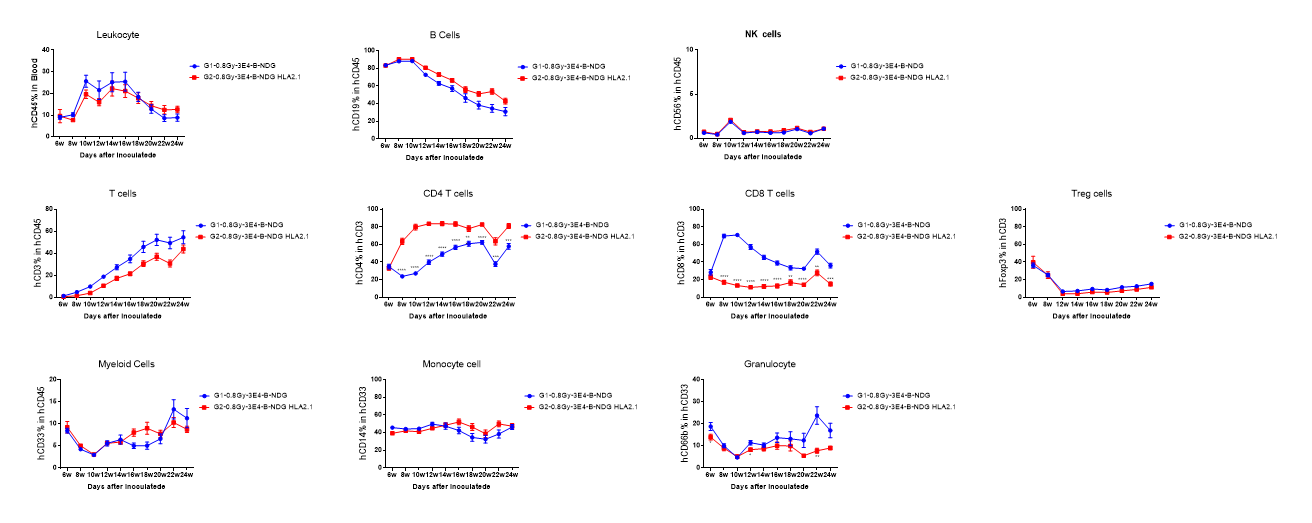
그림 2. 인간 CD34+ HSC가 B-NDG HLA-A2.1 마우스에 정상적으로 정착. 인간 CD34+ HSC는 방사선 조사를 0.8Gy로 수행한 신생아 마우스의 B-NDG HLA-A2.1 마우스와 B-NDG 마우스에 각각 정착하였다. 인간 백혈구는 흐름 세포 측정법(Flow Cytometry)으로 분석되었다. 결과는 B-NDG HLA-A2.1 마우스에서 hCD8+ T 세포의 비율이 B-NDG 마우스보다 유의미하게 낮고, 재구성 24주 후에도 약 18%로 지속되고 있음을 보여주었다. B-NDG HLA-A2.1 마우스에서 hCD4+ T 세포의 비율은 B-NDG 마우스보다 유의미하게 높았다. 다른 재구성된 세포 유형의 비율은 B-NDG 마우스와 유사했다. 값은 평균 ± SEM으로 표시되었다. 통계 분석은 각 치료군을 G1과 비교하여 t-검정을 통해 수행되었다. *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001. (실험 번호: 21P026719).
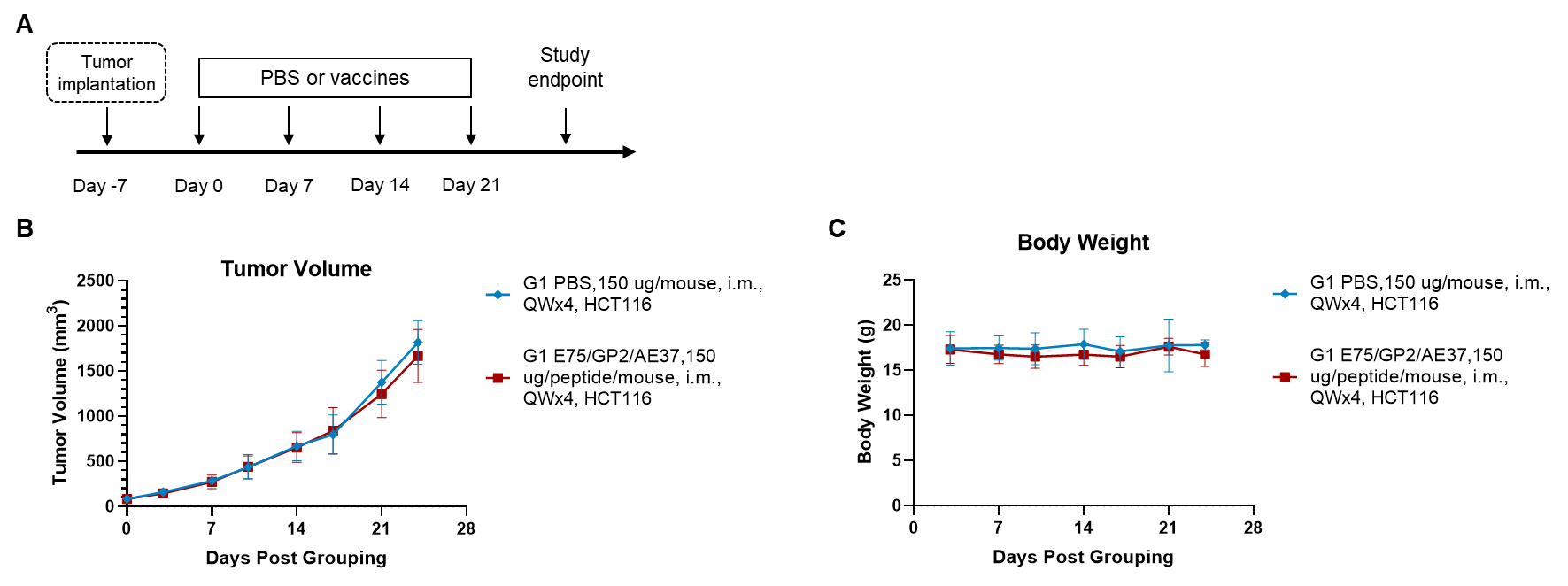
그림 1. 이종 이식 종양에서 펩타이드 백신의 항종양 활성. (A) 실험 계획. (B) 백신에 의한 예방 치료의 항종양 활성. HCT-8 세포는 B-NDG hB2M/HLA-A2.1 마우스 (HSC 재구성)의 우측 복부에 접종되었다. B-NDG hB2M/HLA-A2.1 마우스 (HSC 재구성) (n = 8/군)은 펩타이드 백신으로 면역화되었다. (C) 치료 중의 체중 변화. 값은 평균 ± SEM으로 표시되었다.
Ex vivo 백신 평가 능력:

mCD3e 항체로 자극한 비장 세포의 IFN-γ ELISpot 아세이

IFN-γ ELISpot 아세이의 통계적 히스토그램과 플레이트 뷰. C57BL/6 마우스에서 얻은 비장 세포는 5.00×104-2.50×105/웰의 밀도로 도말되었다. 스폿 수는 mCD3e 항체로 자극된 비장 세포에서 생성된 IFN-γ의 양을 나타내며, 면역 세포 활성화 수준에 대한 정보를 제공한다. 값은 평균 ± SEM으로 표시되었다.
그림 1. B-HLA-A2.1 마우스에서 펩타이드 백신에 의한 면역 반응의 검출 (mIFN-γ ELISpot 아세이). 6〜8주령의 암컷 B-HLA-A2.1 마우스를 PBS군과 펩타이드 백신군 (n = 6)으로 나누어 각각 양쪽 다리에 PBS 또는 백신을 접종하였다. 마지막 면역 후 1주일 후, 마우스를 희생하고 비장 세포를 채취하여 개별 펩타이드 또는 타겟 비관련 폴리펩타이드를 음성 대조군(NC)으로 자극하고 IFN-γ 분비 및 항원 특이적 T 세포를 측정하였다. (A) 실험 계획. (B) 면역화된 마우스에서 채취한 비장 세포의 자극 결과의 대표적인 결과 (음성 대조군, 펩타이드 백신, 또는 양성 대조군에서 2중복). (C) 결과의 요약. 값은 평균 ± SEM으로 표시되었다.
NC: 음성 대조군. PC: 양성 대조군
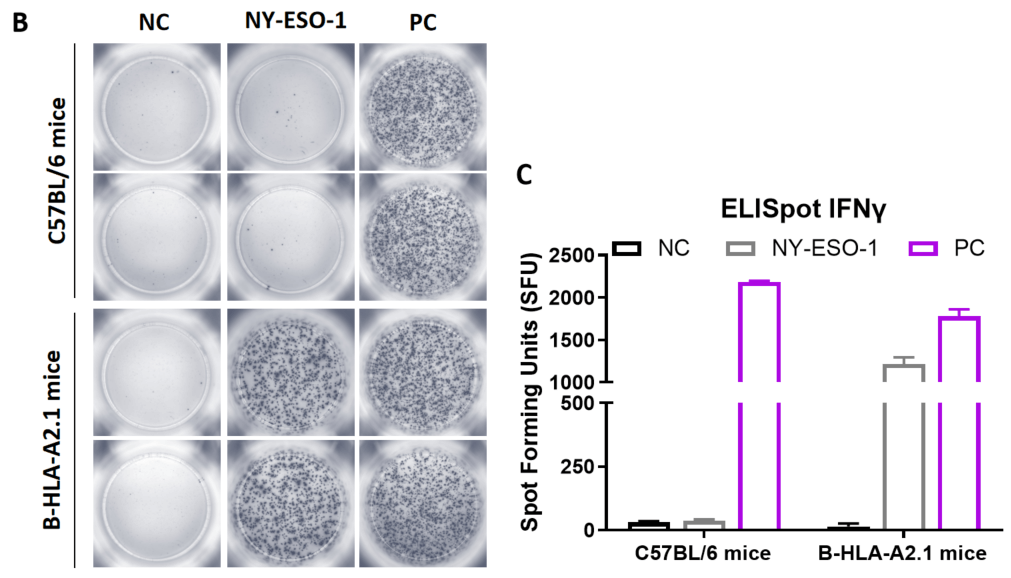
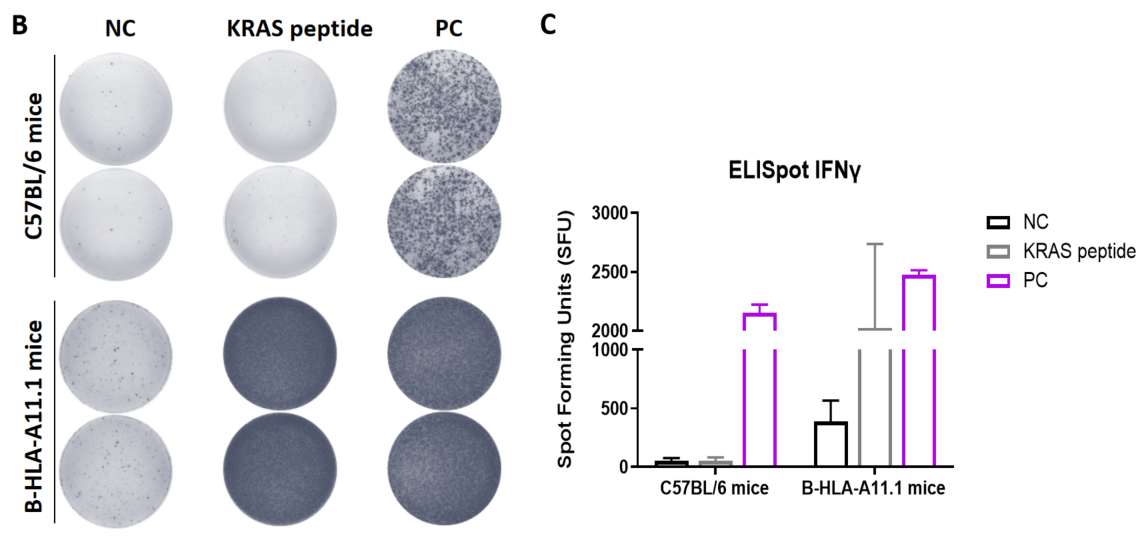
그림 1. B-HLA-A11.1 마우스에서 펩타이드 백신에 의한 면역 반응의 검출 (mIFN-γ ELISpot 아세이). 6〜8주령의 암컷 B-HLA-A11.1 마우스를 PBS군과 펩타이드 백신군 (n = 6)으로 나누어 각각 양쪽 다리에 PBS 또는 백신을 접종하였다. 마지막 면역 후 1주일 후, 마우스를 희생하고 비장 세포를 채취하여 개별 펩타이드 또는 타겟 비관련 폴리펩타이드를 음성 대조군(NC)으로 자극하고 mIFN-γ 분비 및 항원 특이적 T 세포를 측정하였다. (A) 실험 계획. (B) 면역화된 마우스에서 채취한 비장 세포의 자극 결과의 대표적인 결과 (음성 대조군, 펩타이드 백신, 또는 양성 대조군에서 2중복). (C) 결과의 요약. 값은 평균 ± SEM으로 표시되었다.
NC: 음성 대조군. PC: 양성 대조군
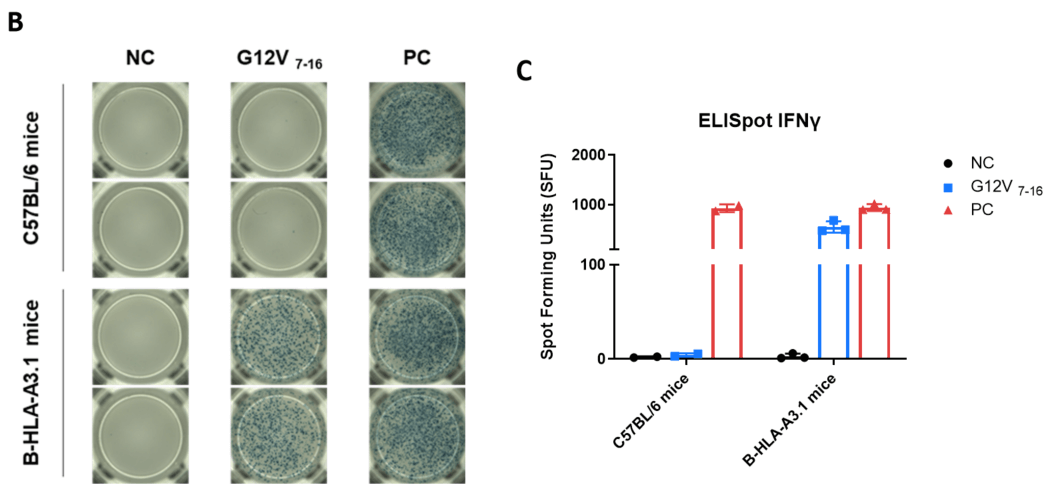
펩타이드 백신에 의한 면역 반응의 검출 (IFN-γ ELISpot 아세이) B-HLA-A3.1 마우스에서. 7〜8주령의 암컷 C57BL/6 마우스 및 B-HLA-A3.1 마우스를 PBS군과 G12V 7-16군 (n = 3)으로 나누어 각각 양쪽 다리에 PBS 또는 백신을 접종하였다. 비장 세포를 채취하여 개별 펩타이드 또는 타겟 비관련 폴리펩타이드를 음성 대조군(NC)으로 자극하고 IFN-γ 분비를 측정하였다. (A) 면역화된 마우스에서 채취한 비장 세포의 펩타이드 백신에 의한 자극의 대표적인 결과 (2중복). (B) 결과의 요약. (C) 결과의 요약. 값은 평균 ± SEM으로 표시되었다.