이 페이지에서
소형 핵산 약물, 즉 올리고뉴클레오타이드 약물은 주로 안티센스 올리고뉴클레오타이드 (ASO), 작은 간섭 RNA (siRNA), 작은 활성화 RNA (saRNA), 마이크로 RNA (miRNA), 아프타머 RNA, CpG 올리고뉴클레오타이드로 분류됩니다. 이들 약물은 핵산 (RNA 또는 DNA)과 상호작용하여 유전자 발현을 조절하고, 유전적 또는 분자 수준에서 작용합니다. 그들은 높은 특이성, 설계 용이성, 짧은 개발 주기, 광범위한 타겟 범위, 그리고 지속적인 효능과 같은 뛰어난 장점을 제공합니다.
Biocytogen은 올리고뉴클레오타이드 약물의 임상 전 연구를 위해 특별히 설계된 일련의 인간화 마우스를 개발했습니다. 이 모델들은 더 안전하고 효과적인 핵산 치료법 개발을 촉진하는 것을 목표로 합니다.
| Efficacy | MOA | Safety |
|
|
|
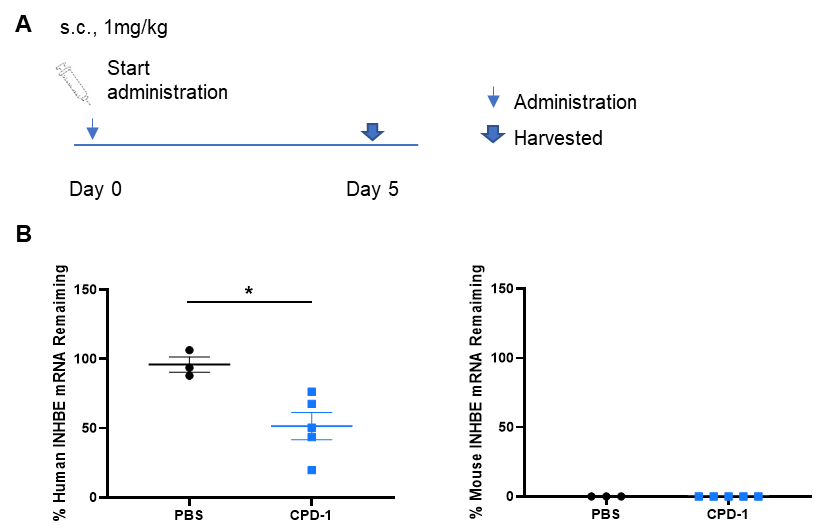
B-hINHBE 마우스에서 인간 INHBE에 대한 핵산 약물의 억제 효율. B-hINHBE 마우스는 무작위로 두 그룹 (수컷, 9-10주령)으로 나누어, 인간 INHBE 타겟의 핵산 약물 (고객 제공)과 PBS를 각각 단독으로 투여하였습니다. 핵산 약물은 PBS 수용액 형태로 투여되었습니다. 마우스는 5일째에 희생되었고, 간 조직을 수집하여 qPCR을 통해 인간 INHBE mRNA 발현 수준을 측정하였습니다. (A) 실험 처리 개요. (B) 간에서의 인간 INHBE mRNA 발현. CPD-1 군은 대조군에 비해 인간 INHBE가 유의미하게 낮았습니다. 데이터는 평균값 ± SEM으로 표현됩니다.
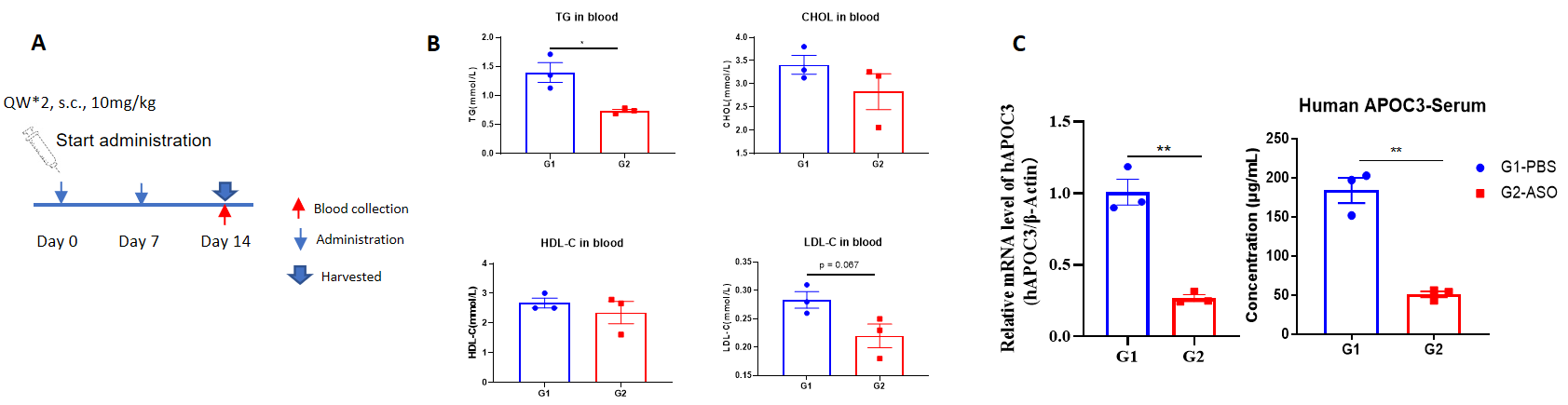
B-hAPOC3 마우스에서 인간 APOC3에 대한 핵산 약물의 억제 효율. B-hAPOC3 마우스는 무작위로 두 그룹 (n=3/그룹, 6주령)으로 나누어, 인간 APOC3 타겟의 핵산 약물 (특허 기반 합성)과 PBS를 각각 단독으로 투여하였습니다. 핵산 약물은 PBS 수용액 형태로 투여되었습니다. 모든 동물의 약물 용량은 체중에 맞춰 계산되었습니다. 마우스는 14일째에 희생되었고, 간 조직을 수집하여 qPCR을 통해 인간 APOC3 mRNA 발현 수준을 측정하였습니다. (A) 실험 처리 개요. (B) 치료 후 B-hAPOC3 마우스의 혈중 지질 수준. 대조군 (G1)과 비교하여, 치료군 (G2)은 트리글리세리드 (TG)가 유의미하게 낮았습니다. (C) 간에서의 인간 APOC3 mRNA 발현 및 혈청 중 인간 APOC3 단백질. 치료군 (G2)에서 인간 APOC3 mRNA가 대조군 (G1)보다 유의미하게 낮았고, 억제율은 73.4%였습니다. 이는 B-hAPOC3 마우스가 인간 APOC3 타겟 핵산 약물의 체내 평가에 강력한 임상 전 모델을 제공함을 보여줍니다. 데이터는 평균값 ± SEM으로 표현됩니다.
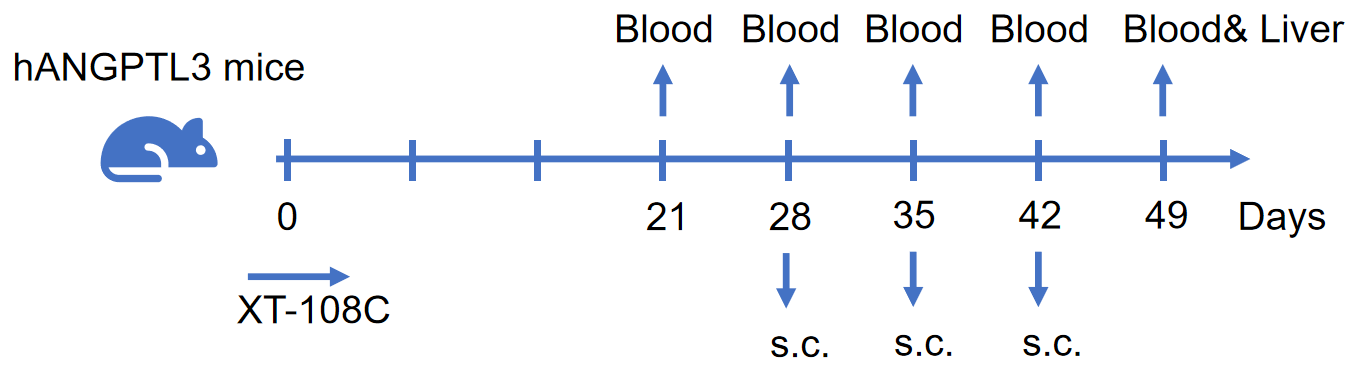
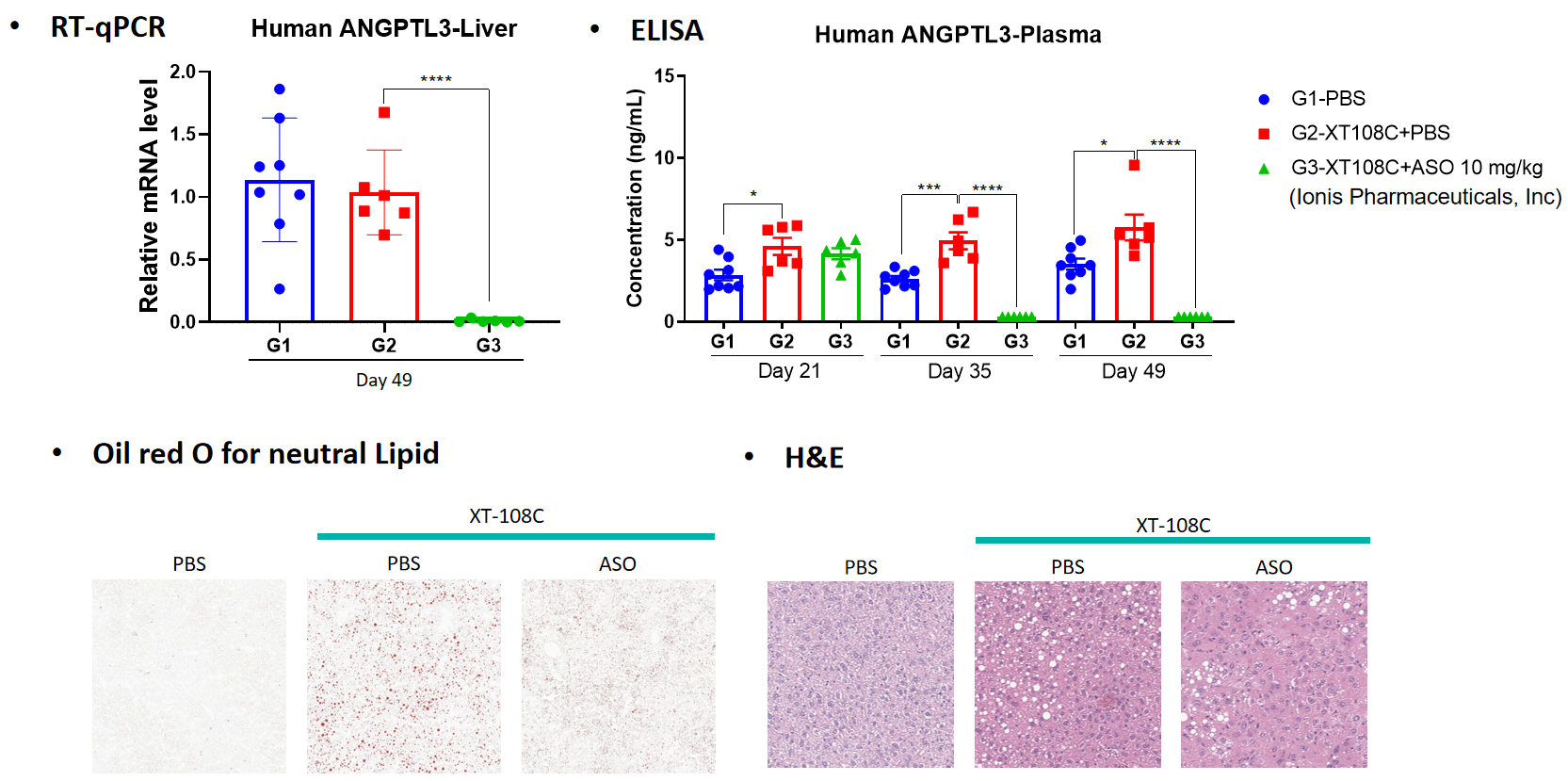
약리학:
병리학적 분석:
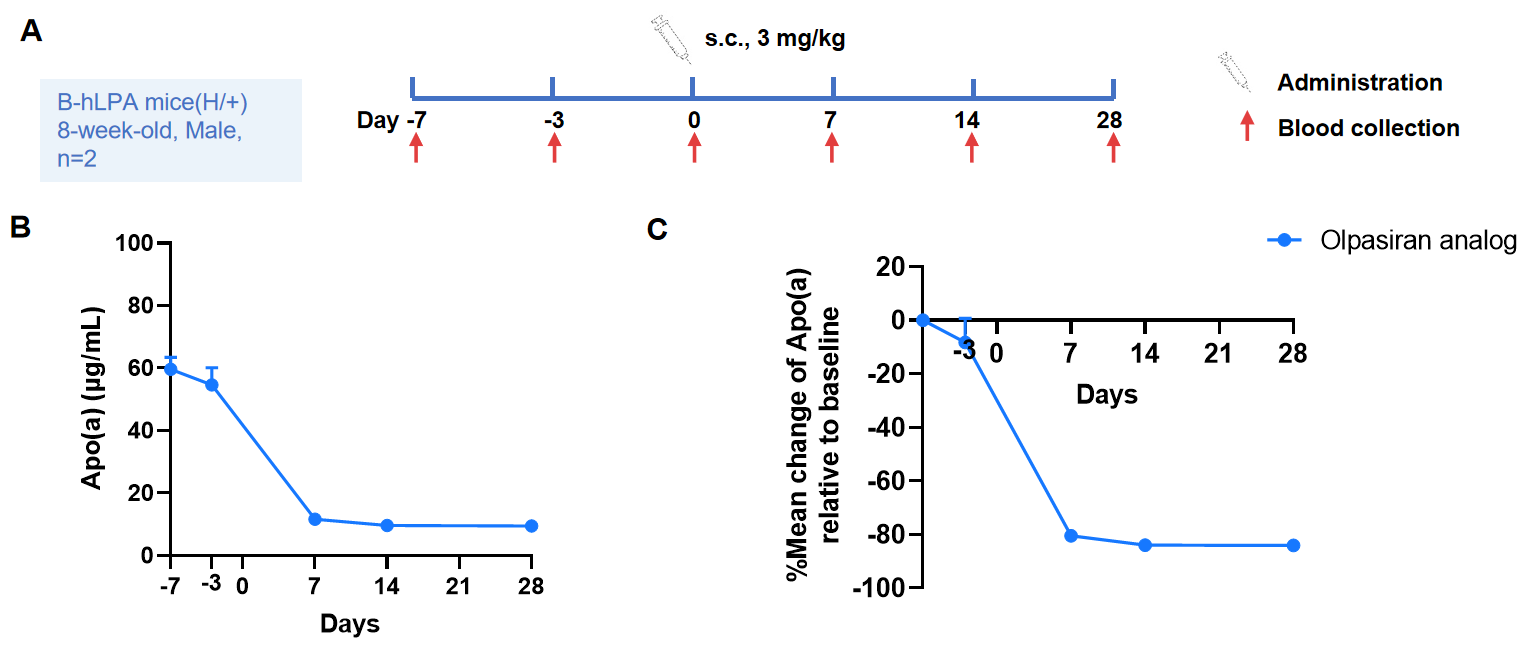
Olpasiran 유사체가 잡종 B-hLPA 마우스의 혈장 Apo(a) 수준에 미치는 변화。Olpasiran 유사체(고객 제공)는 지단백(a)을 타겟으로 하는 이중 가닥 작은 간섭 RNA(siRNA)로, 혈장 Lp(a) 농도를 유의미하게 감소시킵니다. 패널에 표시된 바와 같이, Olpasiran 유사체는 잡종 B-hLPA 마우스에서 Apo(a) 농도를 낮추었고(A), 단일 투여 후 기준선에서 80% 이상 감소를 달성했습니다(B). 이 마우스는 약효 전임상 연구에 사용될 수 있습니다.
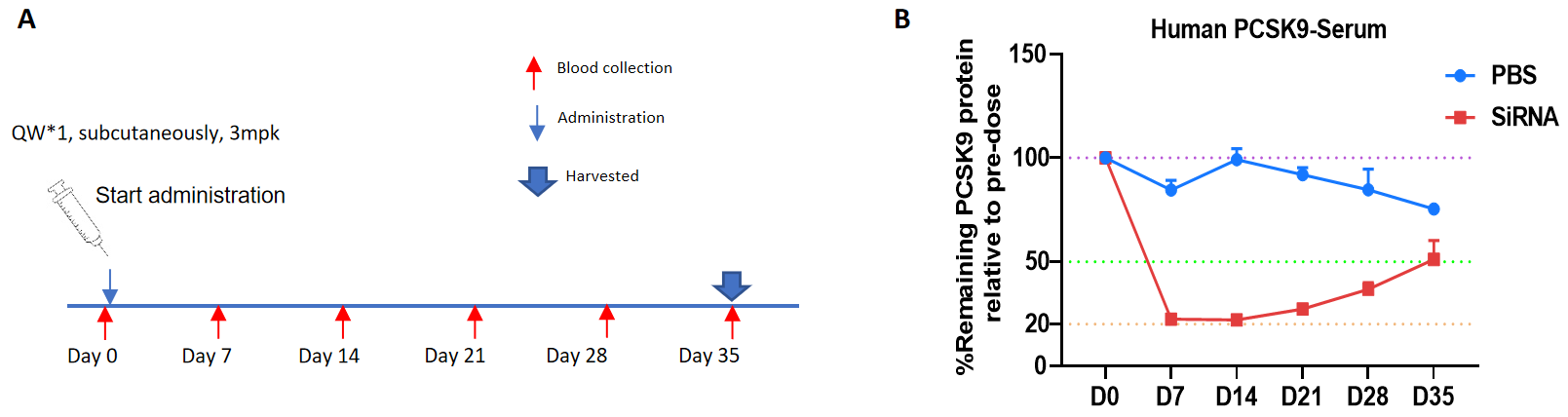
PCSK9 타겟 핵산 약물이 순합 B-hPCSK9 마우스에서 보인 억제 효율。B-hPCSK9 마우스는 2개의 그룹(10주령, 수컷)으로 무작위 배정되었으며, 사람 PCSK9 타겟 핵산 약물인 Inclisiran(특허 합성)과 PBS가 각각 투여되었습니다. 핵산 약물은 PBS 수용액 형태로 투여되었습니다. 마우스는 35일째에 희생되었습니다. (A) 실험 처리 개요.(B) 투여 후 7일, 14일, 21일, 28일, 35일에 혈청 내 PCSK9 단백질 수준의 변화를 투여 전과 비교했습니다. 치료 그룹(G2)의 PCSK9 수준은 대조군(G1)에 비해 감소했으며, B-hPCSK9 마우스는 사람 PCSK9 타겟 핵산 약물의 전임상 모델로 강력한 평가를 제공하는 것으로 나타났습니다. 데이터는 평균 ± 표준 오차(SEM)로 표시됩니다.