이 페이지에서
Biocytogen은 강력한 체외 세포 기능 평가 서비스를 제공합니다. 원시 세포와 확립된 세포주를 사용하여 후보 항체의 체외 약리를 평가하고, 결합 능력과 Fc 및 Fab 관련 특성을 검사합니다. 우리의 접근법은 유세포 분석, ELISA, HTRF, Incucyte 세포 이미징 등 고급 기술을 포함하고 있습니다. 이러한 평가는 후보 항체의 효능과 독성 메커니즘에 대한 귀중한 통찰을 제공하며, 임상 전환 연구를 지원합니다.
체외 약리 서비스에는 다음과 같은 검사들이 포함됩니다:
1. 일반 검사
2. Fab 관련 기능 검사
비면역 세포
사이토카인
3. 면역세포 기반 검사
유세포 분석:
IncuCyte:
사이토카인 분석:






Fc 관련 기능 검사
Fab 관련 기능 검사

PBMCs는 효과 세포로 사용됩니다. 타겟 세포는 고농도 CFSE로 표지된 Jurkat-h4-1BB 세포이며, 대조 세포는 저농도 CFSE로 표지된 Jurkat WT 세포입니다. 이 세포들은 다양한 농도의 항인간 4-1BB 항체가 존재하는 상태에서 18시간 배양됩니다.
세포독성 비율은 다음과 같이 계산됩니다: [1 - (대조군 비율 / 실험군 비율)] × 100. 비율은 CFSElow 세포 수를 CFSEhigh 세포 수로 나눈 값으로 결정됩니다.
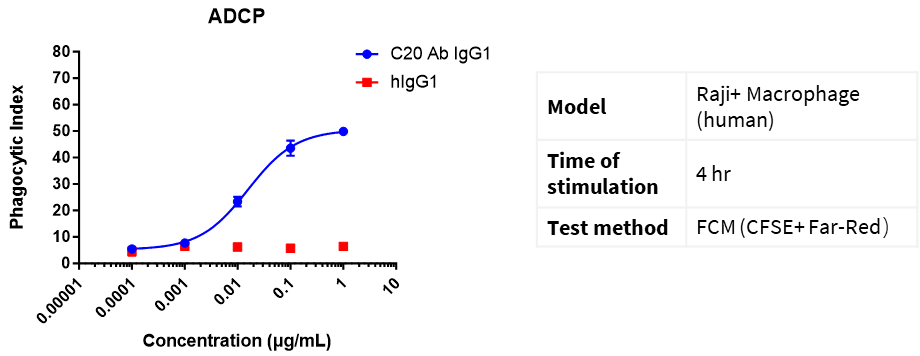
멀티레드 염료로 대식세포(E)를 표지하고, CFSE 염료로 Raji 세포(T)를 표지했습니다. E:T = 1:5. 다양한 농도의 CD20 IgG1 항체를 추가하고 4시간 동안 배양한 후, 유세포분석을 통해 대식세포의 식세포작용을 측정했습니다.
식세포지수(PI) = (섭취된 대식세포 수) / (대식세포 총수) × 100%
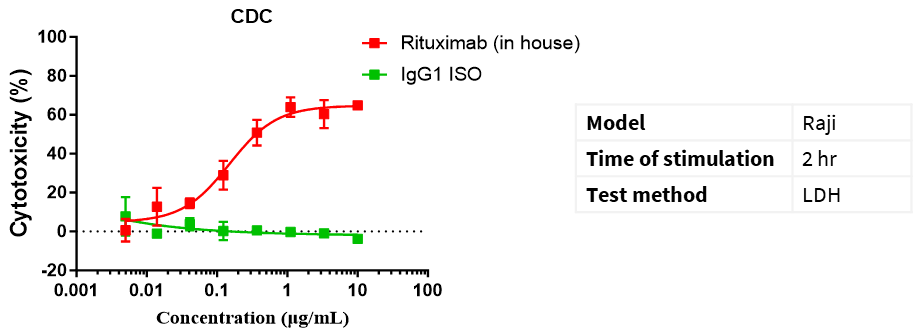
CD20 IgG1 항체를 이용한 CDC 실험. Raji 세포를 다양한 농도의 CD20 IgG1 항체와 보체와 혼합하여 2시간 배양합니다. 항체의 세포독성 효과는 LDH 방법으로 측정됩니다.
세포독성 % = (시험군 LDH 값 - 자발적 방출군 LDH 값) / (타겟 세포의 최대 LDH 방출 값 - 자발적 방출군 LDH 값) × 100%
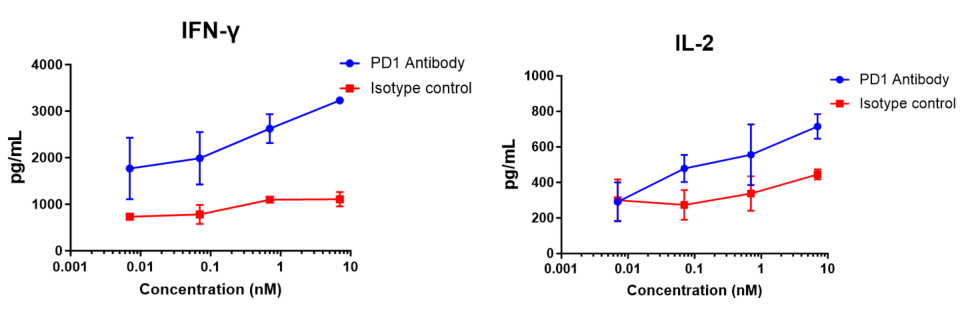
인간 CD4+ T 세포와 동종 수지상 세포를 10:1 비율로 96웰 원형 바닥 플레이트에 혼합한 후, 다양한 농도의 nivolumab(자체 제작)을 추가하고 120시간 배양한 후, ELISA로 IFN-γ 방출을 측정했습니다. 결과는 nivolumab(자체 제작)이 MLR에서 IFN-γ와 IL-2 생산을 용량 의존적으로 증가시킨다는 것을 보여주었습니다.
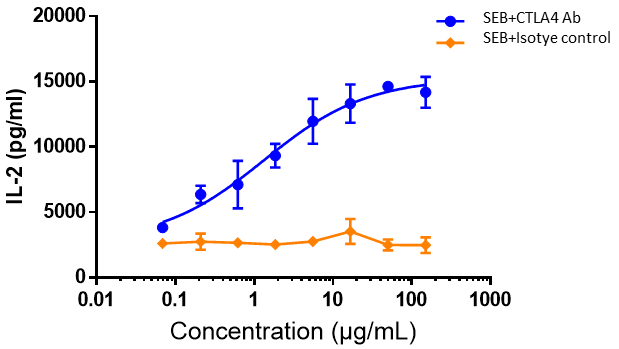
인간 PBMC를 SEB(10 ng/mL)와 함께 배양한 후, 다양한 농도의 ipilimumab 또는 아이소타입 대조 항체를 추가하고 48시간 추가 배양한 후, ELISA로 IL-2 방출을 측정했습니다. 결과는 ipilimumab이 SEB 자극 PBMC에서 IL-2 생산을 용량 의존적으로 증가시킨다는 것을 보여주었습니다.
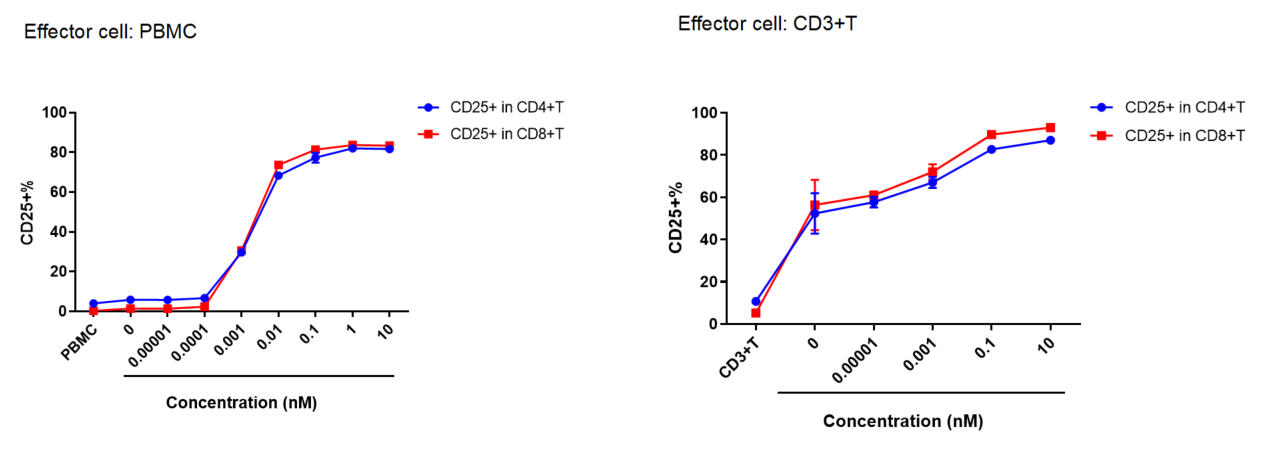
PBMC 또는 CD3+ T 세포를 Daudi 세포와 공동 배양하고, 다양한 농도의 CD3, CD19 이중특이성 항체(BiTE)를 추가했습니다.
48시간 후, CD4 및 CD8 T 세포의 활성화가 측정되었습니다. 항체 농도가 증가함에 따라 활성화된 T 세포(CD25+)가显著 증가했습니다.



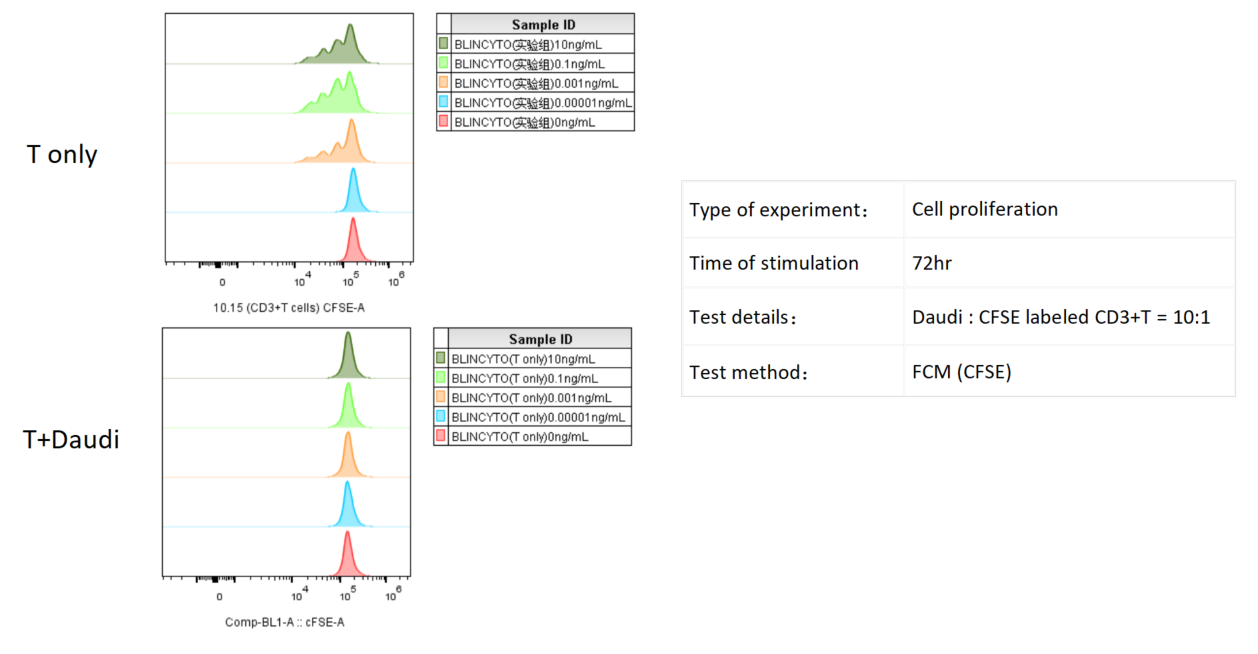
Daudi 세포와 CFSE로 표지된 CD3+ T 세포를 공동 배양하고, 다양한 농도의 Blinatumomab으로 처리한 후, T 세포 증식을 유세포분석으로 3일 후 측정했습니다. 결과는 Daudi 세포가 존재하는 경우, Blinatumomab의 농도가 증가할수록 T 세포 증식이显著 증가함을 보여주었습니다.
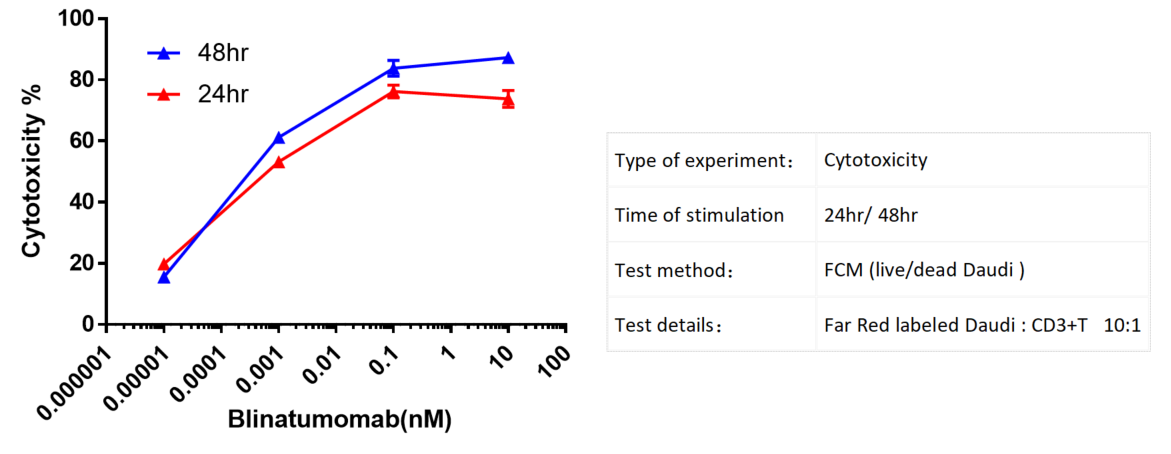
Far Red로 표지된 Daudi 세포를 CD3+ T 세포와 공동 배양하고, 다양한 농도의 Blinatumomab으로 처리한 후, 24시간 및 48시간 후에 유세포분석으로 세포독성을 평가했습니다. 항체 농도가 증가할수록 세포독성이显著 증가했습니다.
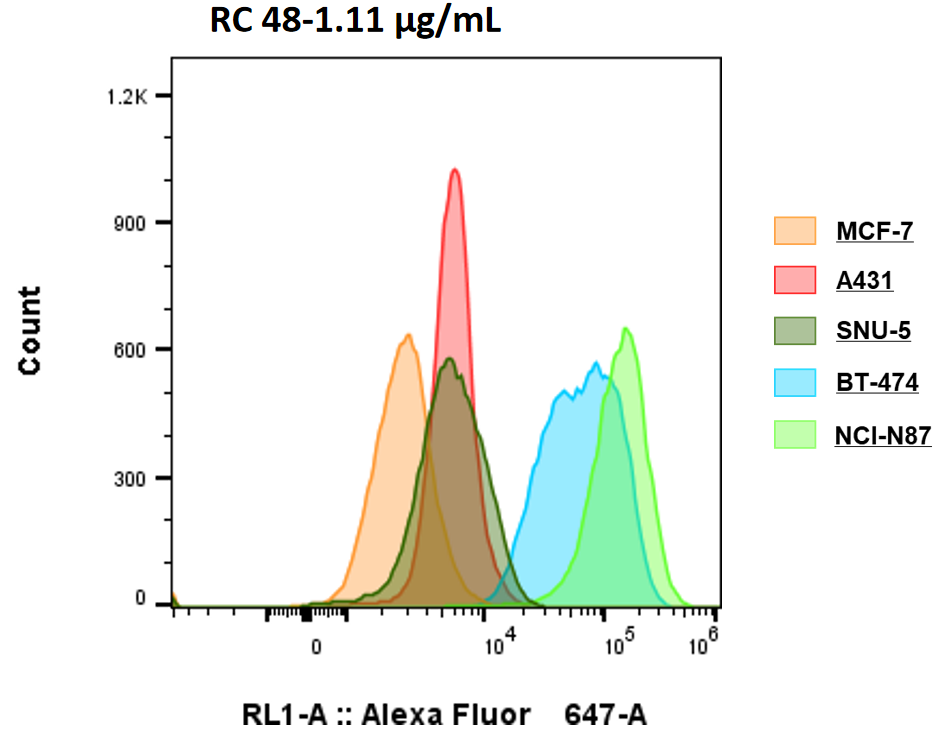
유세포분석으로 5개의 세포주에서 Her2 발현을 측정
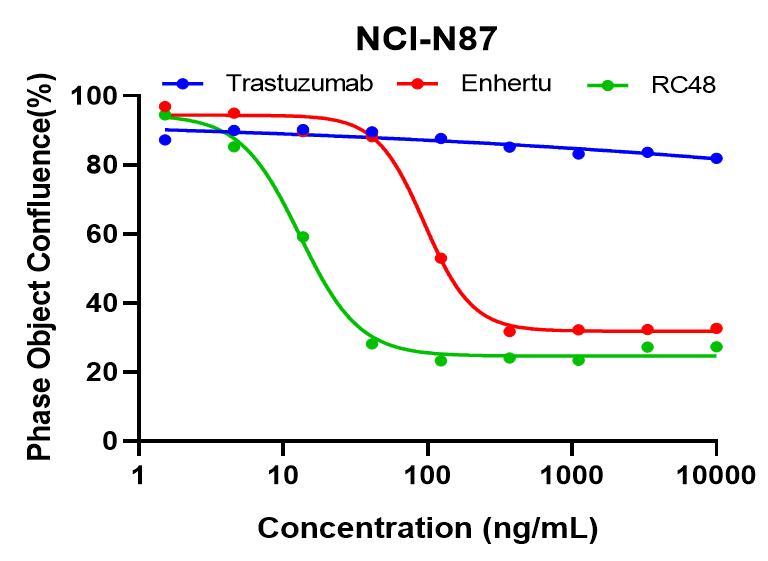
NCI-N87 세포는 다른 농도의 트라스투주맙, Enthertu 또는 Disitamab Vedotin (RC48)으로 처리되었고, 세포 결합률은 Incucyte를 통해 지속적으로 모니터링되었습니다. 그림은 처리 후 6일간의 세포 결합률을 나타냅니다. Enthertu 또는 RC48은 NCI-N87의 증식을 농도 의존적으로 유의미하게 억제했지만, 트라스투주맙은 그렇지 않았습니다.

NCI-N87, MCF-7, BT-474 세포는 각각 FabFluor로 표지된 Disitamab Vedotin(RC48) 또는 트라스투주맙과 24시간 배양되었으며, Incucyte를 통해 지속적으로 관찰되었습니다. 사진에서 주황색 신호는 엔도시토시스된 항체를 나타냅니다. Disitamab Vedotin(RC48)과 트라스투주맙은 NCI-N87(높은 HER2 발현)과 BT-474(높은 HER2 발현) 세포에 시간 의존적으로 엔도시토시스되었으나, MCF-7(HER2 발현 없음) 세포에는 엔도시토시스되지 않았습니다.
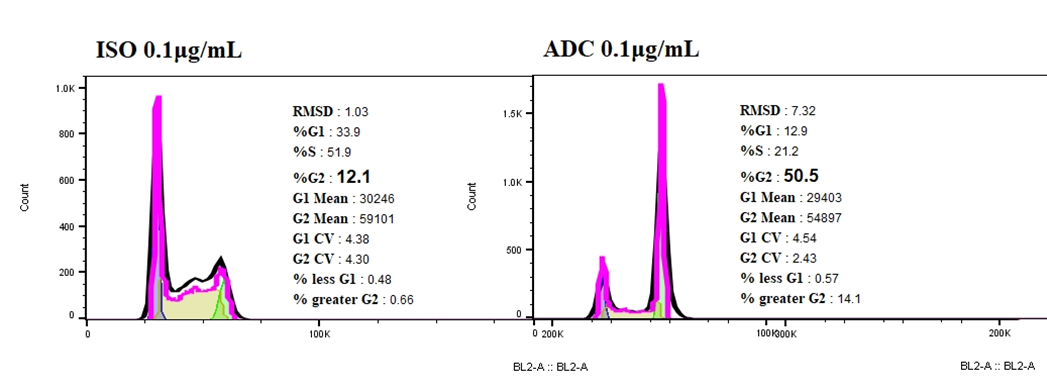
ISO-ADC와 비교하여, Her2-ADC는 NCI-N87에서 세포 주기 정지를 유도하며 G2기 세포 비율이 급격히 증가했습니다.
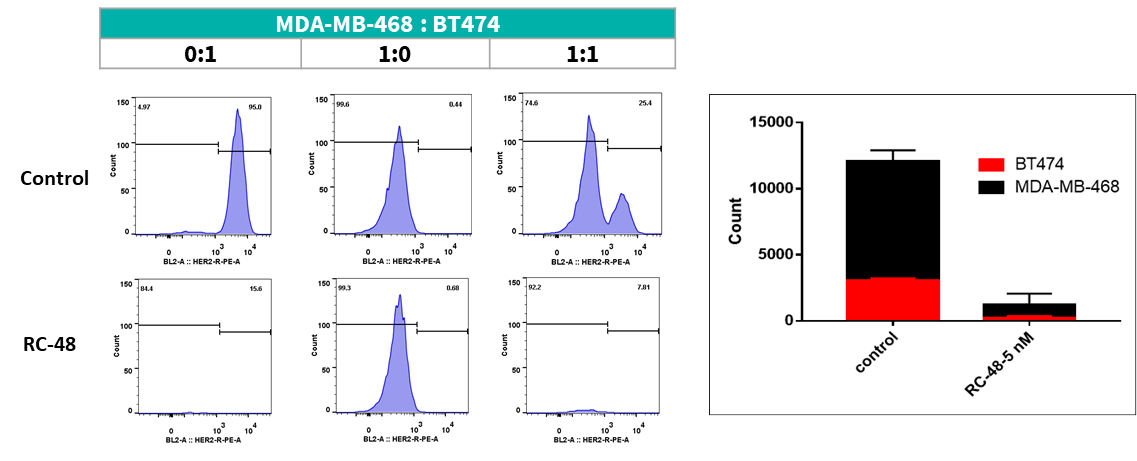
MDA-MB-468 세포(HER2-)와 BT474(HER2+) 세포는 서로 다른 비율(각각 0:1, 1:0, 1:1)로 하룻밤 공배양되었습니다. RC48 또는 대조군으로 5일간 처리 후, 흐름세포계로 세포 수와 HER2 양성 및 HER2 음성 세포의 비율이 측정되었습니다. RC48은 BT474 세포에서 강력한 종양 세포 사멸 효과를 보였지만, MDA-MB-468 세포에서는 거의 세포 독성을 나타내지 않았습니다. 중요한 점은 MDA-MB-468 세포가 BT474 세포와 공배양되었을 때 RC48이 MDA-MB-468 세포도 사멸시킨다는 것입니다.
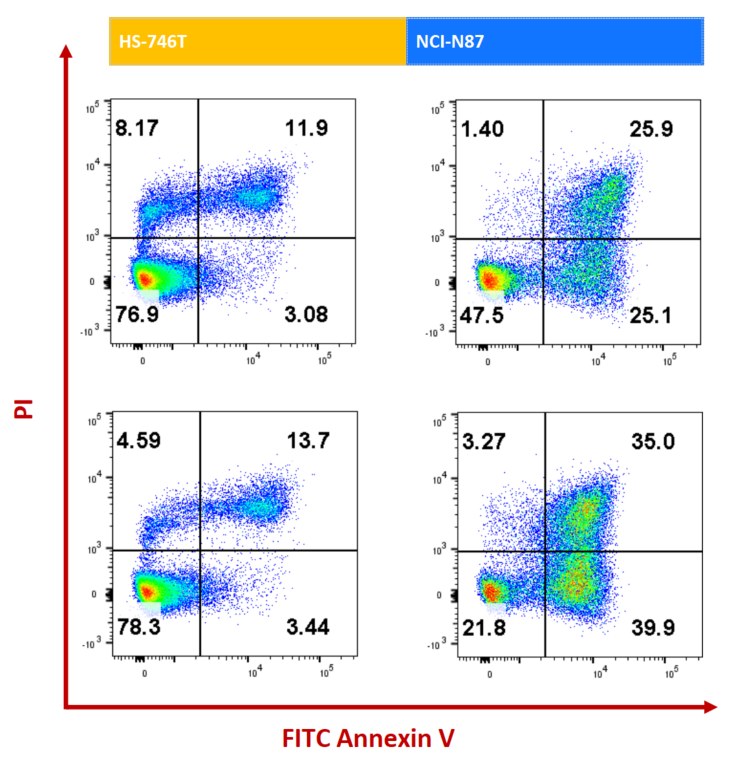
NCI-N87(HER2+) 및 HS-746T(HER2-) 세포는 각각 ISO-MMAE 및 Enthertu로 72시간 처리되었습니다. 아포토시스는 Annexin V/PI 키트를 사용하여 흐름세포계로 측정되었습니다. HER2 고발현 NCI-N87 세포에서 Enthertu는 유의미하게 아포토시스를 유도했습니다.
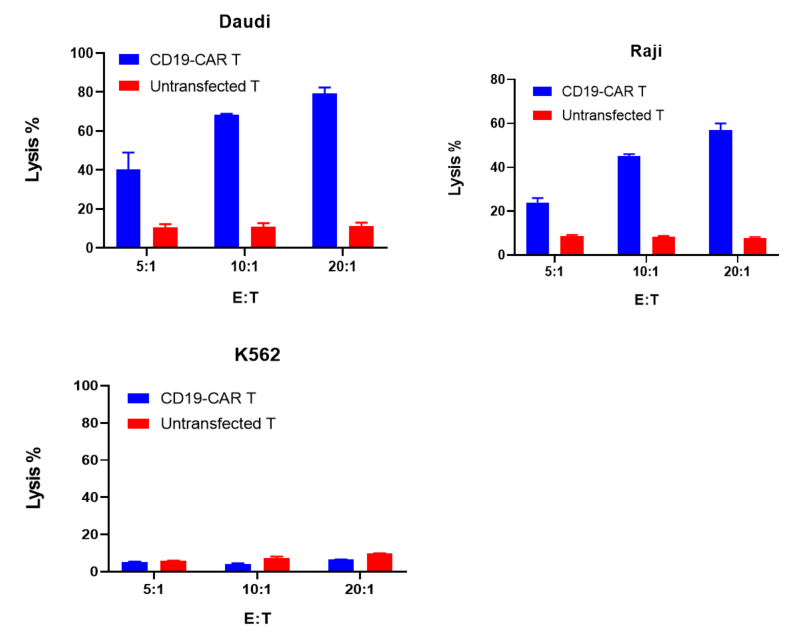
CD19-CAR T 세포 또는 미전달 T 세포는 각각 5:1, 10:1, 20:1의 비율로 Daudi, Raji, K562 타겟 세포와 공배양되었으며, 24시간 후에 세포 독성은 Fixable Viability Dye로 흐름세포계에서 평가되었습니다.
결과는 CD19-CAR T 세포가 CD19를 발현하는 Daudi와 Raji 세포에 대해 유의미한 세포 독성을 나타낸다는 것을 보여주었습니다. 그러나 CD19-CAR T 세포는 CD19 음성인 K562 세포에 대해 특이적인 세포 독성을 나타내지 않았습니다.
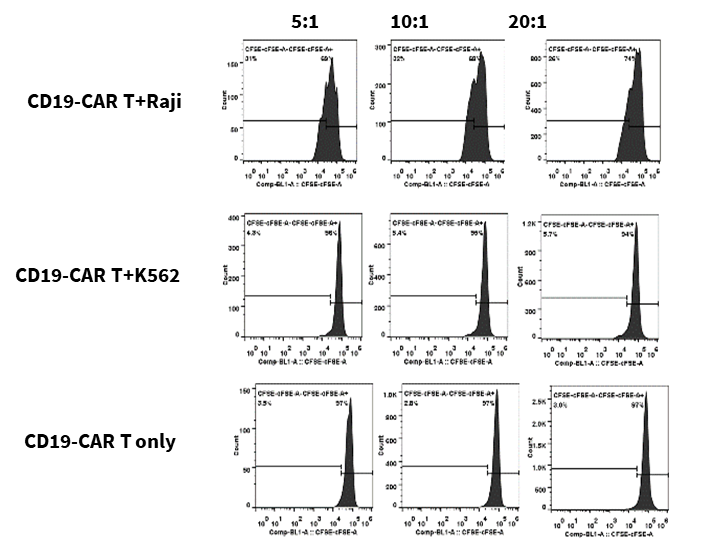
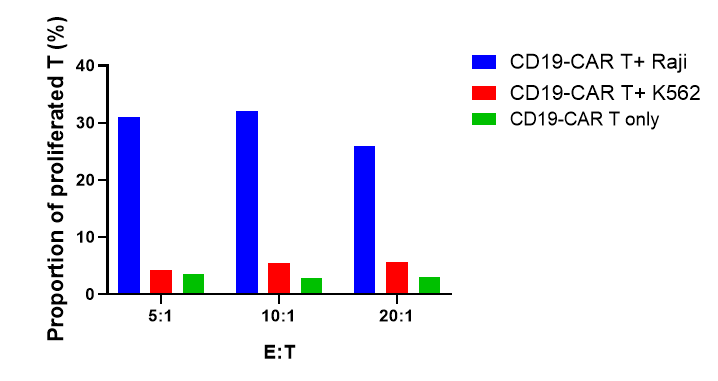
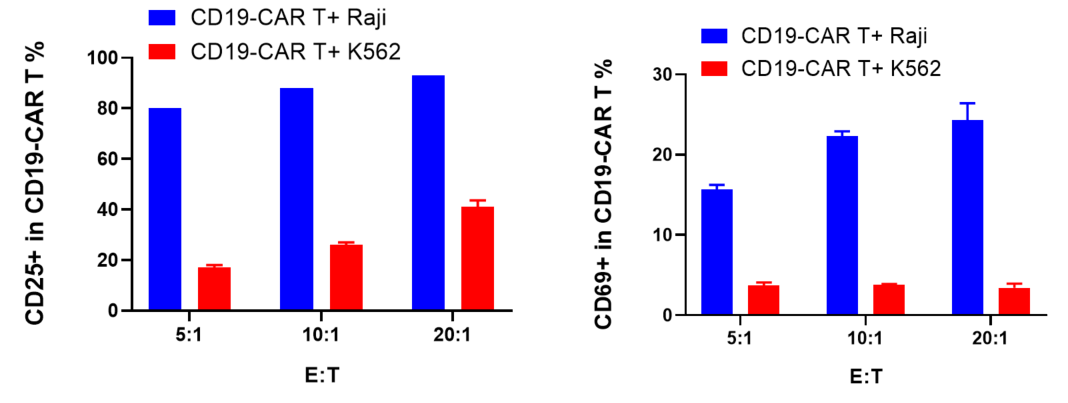
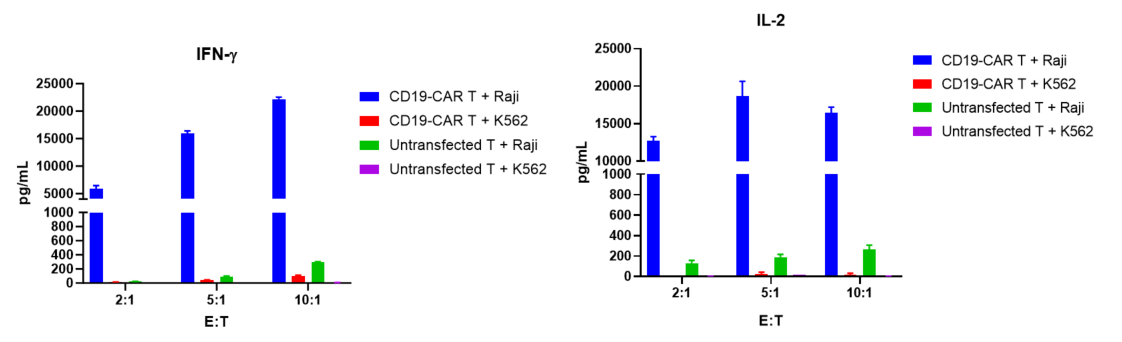
CFSE로 표지된 CD19-CAR T 세포는 Raji 및 K562 타겟 세포와 5:1, 10:1, 20:1의 비율로 공배양되었으며, 72시간 후에 CD19-CAR T 세포의 증식, 활성화 및 세포 인자 방출이 평가되었습니다.
결과는 CD19-CAR T 세포가 CD19를 발현하는 Raji 세포와 공배양될 때 K562 세포(CD19 음성)와 비교하여 유의미하게 증식하고, 활성화되며, 세포 인자를 방출한다는 것을 보여주었습니다.
FACS
Cytokine
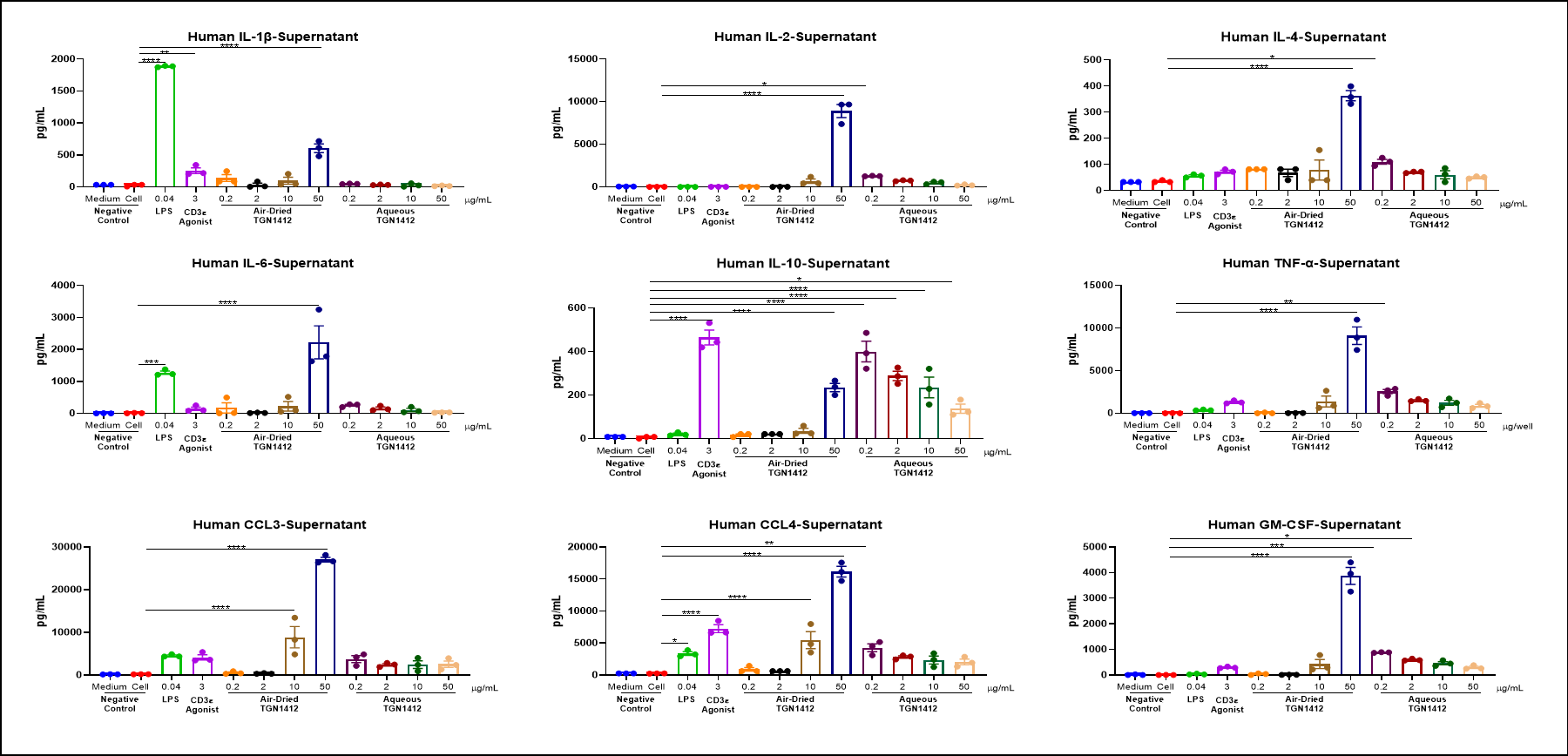
건조 공기 중의 TGN 1412는 in vitro에서 PBMC의 염증 인자 폭풍을 유도할 수 있습니다.
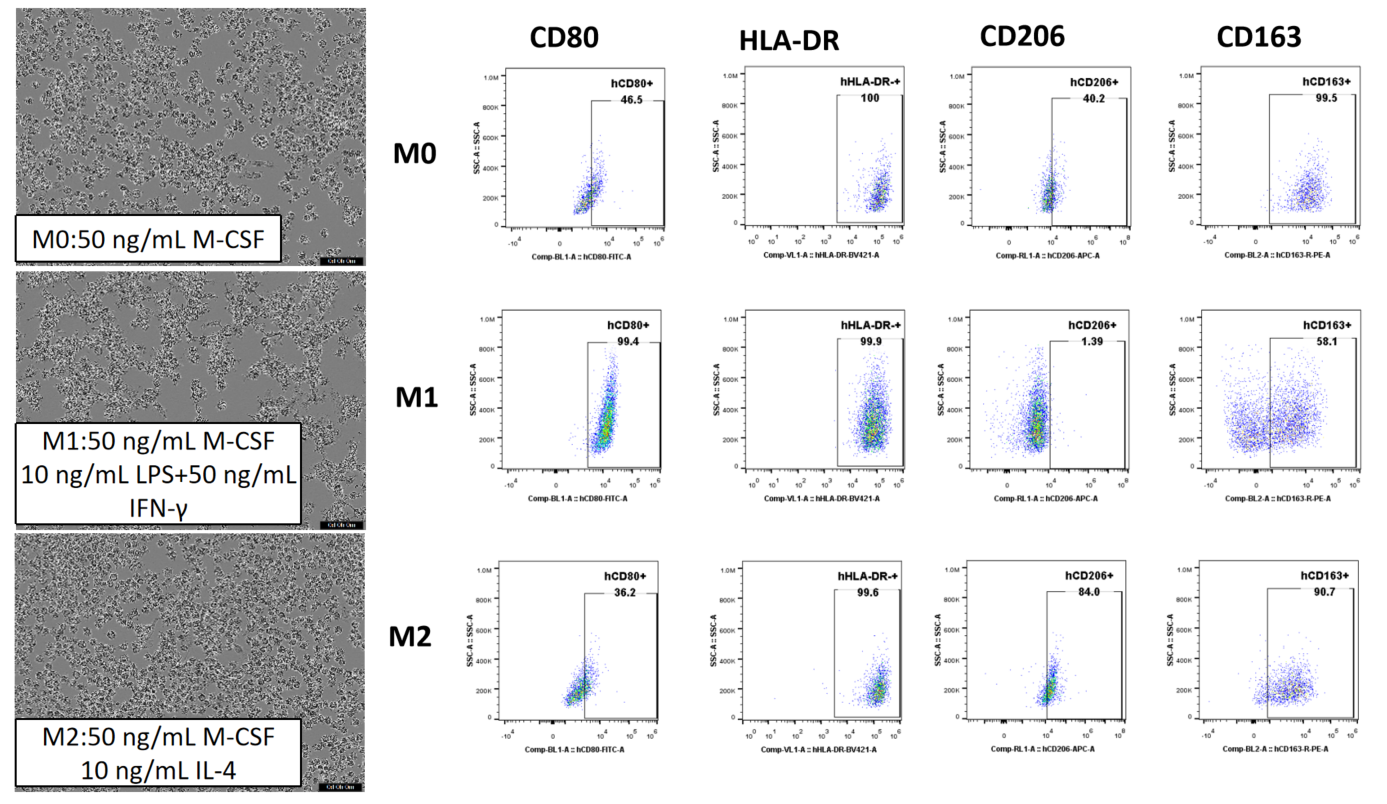
인간 PBMC에서 CD14+ 단핵세포를 자석 비드를 사용하여 분리한 후, 다양한 세포 인자와 6일간 배양하여, 유도 조건에 따라 서로 다른 형태와 표면 마커를 가진 대식세포가 생성되었습니다.
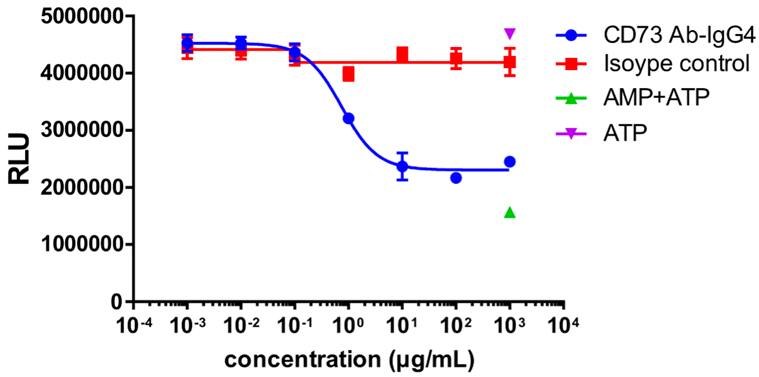
MDA-MB-231 세포는 타겟 세포로 사용되었으며, 다양한 농도의 CD73 항체와 37°C에서 30분 동안 배양되었습니다. AMP를 추가하고 3시간 동안 배양한 후, ATP와 발광 기질을 추가하여 형광 값을 측정하였습니다.
CD73 항체 농도가 증가함에 따라, CD73 효소 활성이 억제되었고 형광 값은 점차 감소했습니다.
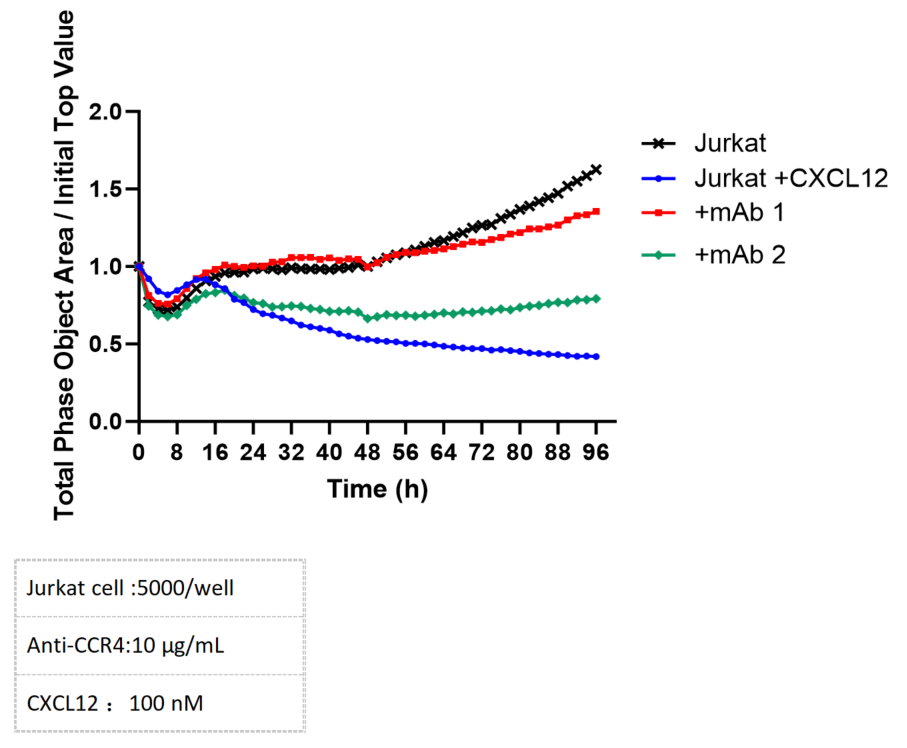
주행 이동은 Incucyte 시스템을 통해 정확하게 모니터링할 수 있습니다. CXCR4 발현 Jurkat 세포의 CXCL12에 대한 주행 반응은 CXCR4 특이적 항체로 효과적으로 억제할 수 있었습니다.