당신도 좋아할 수 있습니다
5月21日,比利时生物技术公司Orionis Biosciences宣布与罗氏集团成员基因泰克(Genentech)达成第二次多年合作,共同开发针对肿瘤领域新颖且具有挑战性靶点的小分子单价分子胶药物,合作金额拟超20亿美元。这笔交易,让分子胶再次站到了全球的聚光灯下。
6月6日,Arvinas宣布已联合辉瑞向FDA递交Vepdegestrant的上市申请(NDA),用于治疗既往接受过内分泌药物治疗的携带ESR1突变的ER+/HER2-晚期或转移性乳腺癌患者。这是全球首个申报上市的PROTAC药物。
目前PROTACs和分子胶主要使用的靶点仍是Cereblon (CRBN),近些年,在靶向蛋白降解领域,CRBN既是革命性的分子胶 (Molecular Glue)核心靶点,也凭借其良好的药代动力学特性成为PROTACs (蛋白水解靶向嵌合体)最常用的E3连接酶受体之一,如来那度胺(Lenalidomide),沙利度胺 (Thalidomide)和泊马度胺(Pomalidomide)。但是这些化合物都会存在一些缺陷,如易消旋和易降解neosubstrate等,所以人们一直在开发新型的CRBN配体。而CRBN只是泛素-蛋白酶体系统用来引导泛素标记过程朝向特定蛋白质组的数百个“适配器”之一。那么为什么它能成为这个领域的热门靶点? 药物的研发进展如何?以及研发过程中最大的阻碍是什么?
靶向蛋白降解技术
在靶向蛋白降解技术掀起制药革命的今天,CRBN作为该领域最广泛研究的E3泛素连接酶受体,正扮演着颠覆性角色。其核心机制在于利用人体天然的泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS) —— 一种主要的蛋白质降解途径,当致病蛋白被泛素活化酶(ubiquitin-activating enzyme, E1)、泛素结合酶(ubiquitin-conjugating enzyme, E2)和CRL4CRBN等泛素连接酶(ubiquitin-protein ligase, E3)依次标记,泛素化和多聚泛素化后,蛋白酶体会精准识别并降解这些蛋白。这一过程能够针对传统小分子抑制剂或抗体药物难以触及的蛋白靶点发挥效力,为传统不可成药靶点提供了全新干预策略。
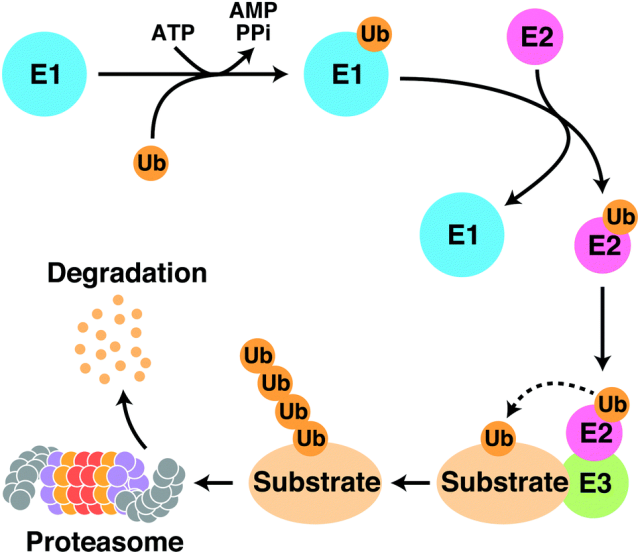
图1. 泛素蛋白酶体系统示意图[1]
CRBN与DNA损伤结合蛋白1 (DDB1)、Cullin4 (Cul4A或Cul4B)和Ring-Box 1(RBX1)相互作用,共同形成CRL4CRBN E3复合物。
靶向蛋白质降解剂
驱动CRBN价值爆发的两大技术支柱分别是分子胶与PROTACs。
分子胶
分子胶类小分子化合物(如来那度胺、泊马度胺)通过嵌入CRBN的三色氨酸口袋(Trp380/386/417),重构其表面拓扑结构,使CRBN与原本不结合的蛋白质(如多发性骨髓瘤关键因子IKZF1/3)发生相互作用,进而触发泛素化降解蛋白质。这种“分子变形术”虽成就了多款重磅药物,却受限于免疫调节酰亚胺(IMiDs)类药物的先天缺陷:沙利度胺的S-对映体易发生消旋化导致活性丧失,而CRBN-neosubstrate的不可预测结合更可能引发脱靶毒性(如沙利度胺的致畸性源于SALL4蛋白误降解)。
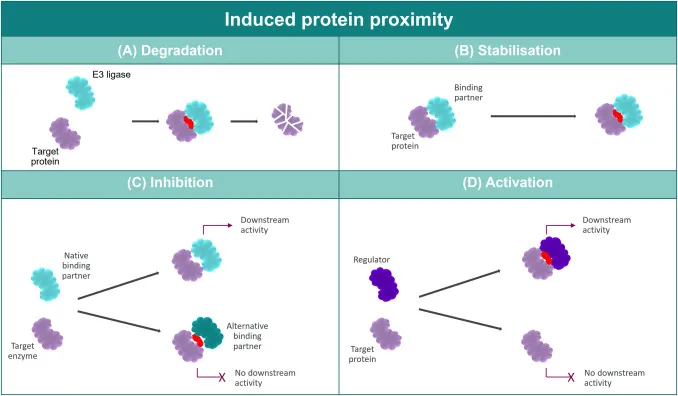
图2. 分子胶诱导蛋白作用机制[2]
PROTACs
PROTAC,即蛋白水解靶向嵌合体,这类双功能分子由靶蛋白配体、E3配体(通常为泊马度胺衍生物)及中间连接子组成,其创新之处在于形成靶蛋白-PROTAC-E3连接酶三元复合物,如同为致病蛋白定制“死亡导链”。相比分子胶,PROTACs可通过调整连接子长度与刚性精准调控降解效率,目前已催生多个临床明星:Arvinas的ARV-471(靶向雌激素受体)在乳腺癌Ⅱ期试验中使患者无进展生存期翻倍,2023年ASCO数据推动其进入Ⅲ期;C4 Therapeutics的CFT8634则通过降解BRD9蛋白,在临床前研究中清除90%的滑膜肉瘤细胞。
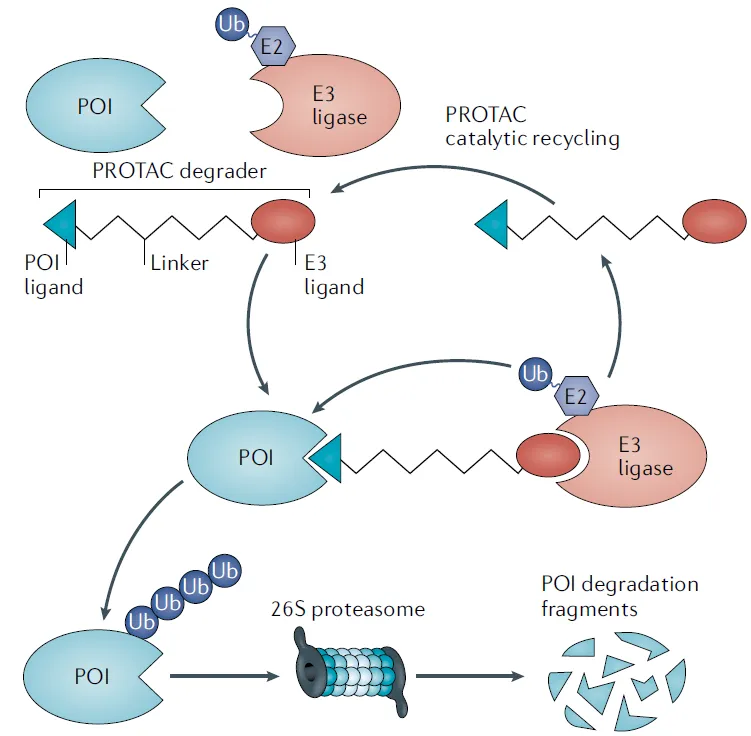
图3. PROTACs的作用原理[3]
CRBN靶点药物研发进
据医药魔方数据库统计,CRBN靶点相关的药物,处在临床前的有七十多个,主要涉及PROTACs和分子胶。适应症主要集中在血液肿瘤、肿瘤领域、免疫领域等领域。
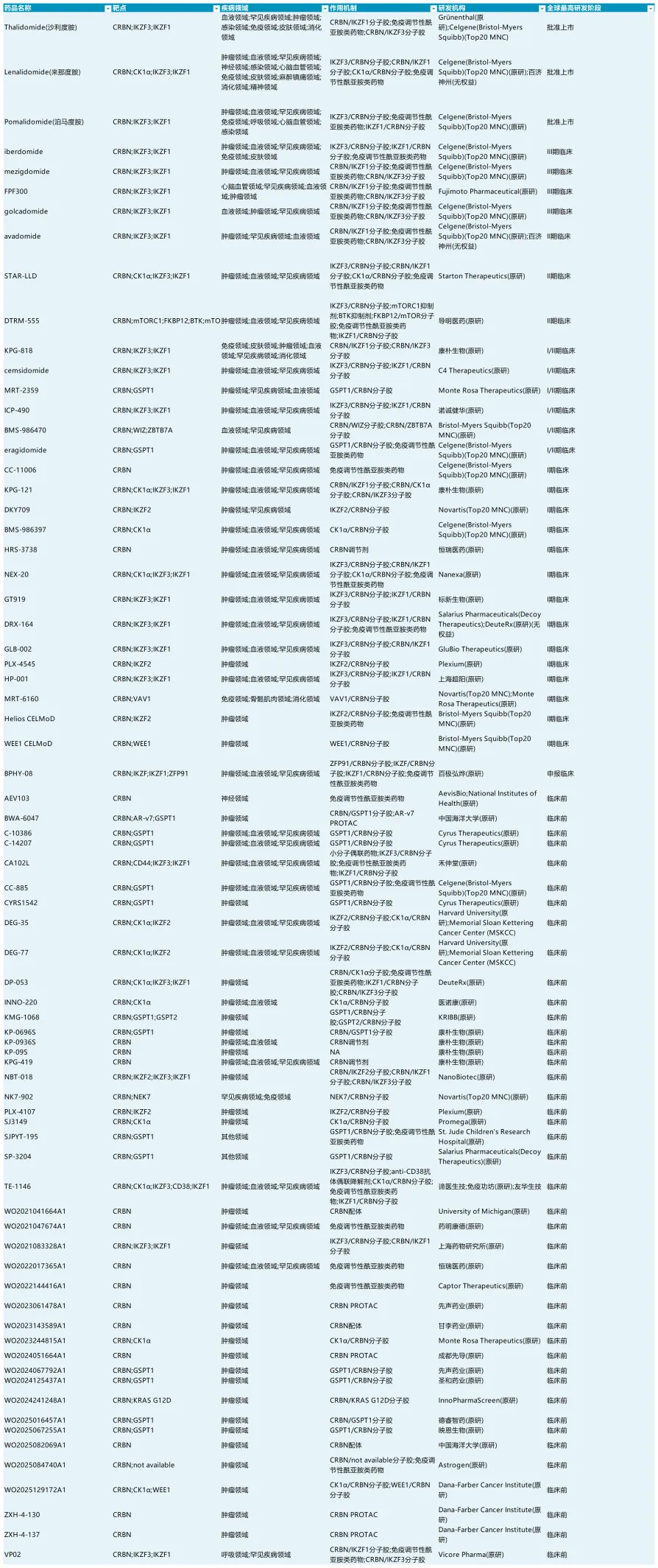
来源:医药魔方NextPharma数据库
B-hCRBN mice的毒性新数据
CRBN配体的开发并非坦途,CC-885作为一种新型CRBN分子胶化合物,通过靶向GSPT1等关键蛋白降解展现出强大的抗肿瘤活性[4]。 尽管人和小鼠CRBN蛋白具有高度同源性,但是仍然存在着一些差别,尤其是在药物的结合位点附近。这些差别使得小鼠的CRBN无法响应药物的处理,这足以破坏CC-885在小鼠体内的抗肿瘤疗效和毒性。因此,缺乏合适的小鼠模型严重限制了相关基础研究的开展以及新疗法的研发。百奥赛图自主开发了CRBN人源化小鼠(产品编号:113236;品系名称:C57BL/6N-Crbntm2(CRBN)Bcgen/Bcgen)。该模型实现了小鼠内源性Crbn基因的完全替换,使小鼠专一性表达人源CRBN蛋白。为评估CRBN靶向蛋白降解剂的体内疗效和毒性提供了强有力的工具。
体内毒性分析
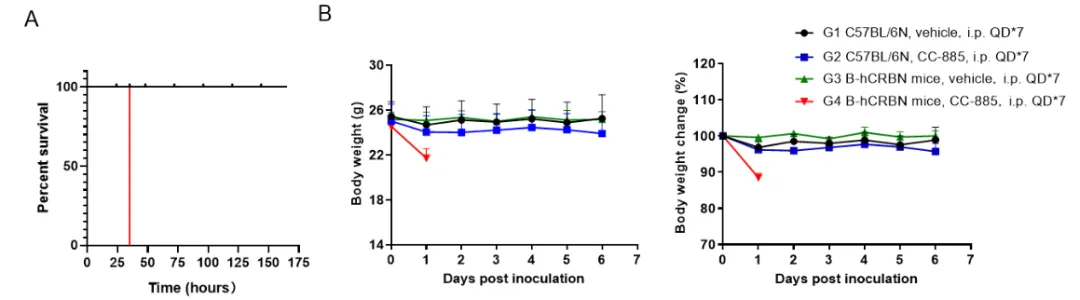
将野生型 C57BL/6 小鼠和同源 B-hCRBN 小鼠分为两组(n=3),每组腹腔注射 5 mg/kg CC-885 (HY-101488) 或溶媒对照。 (A)存活百分比。 (B)治疗期间的体重和体重变化。 结果显示,所有接受 CC-885 治疗的 B-hCRBN 小鼠(G4 组)在注射后约 35 小时死亡,而 G1、G2 和 G3 组存活。 结果表明,CC-885 只对 B-hCRBN 小鼠有明显毒性,而在野生型小鼠中未观察到毒性。
组织病理学分析
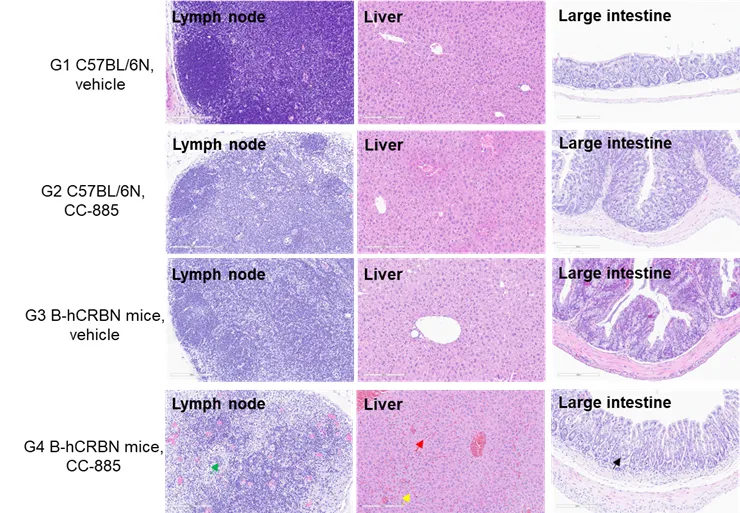
淋巴结、肝脏和结肠组织,采集自注射后 35 小时的 G4 组;G1、G2 和 G3 组的组织在实验结束时取样。 如图所示,G4 组淋巴结出现淋巴细胞坏死;肝组织出现肝瘀血和小泡性脂肪变;结肠组织出现隐窝脓肿。其他组未观察到病理变化。
血生化数据分析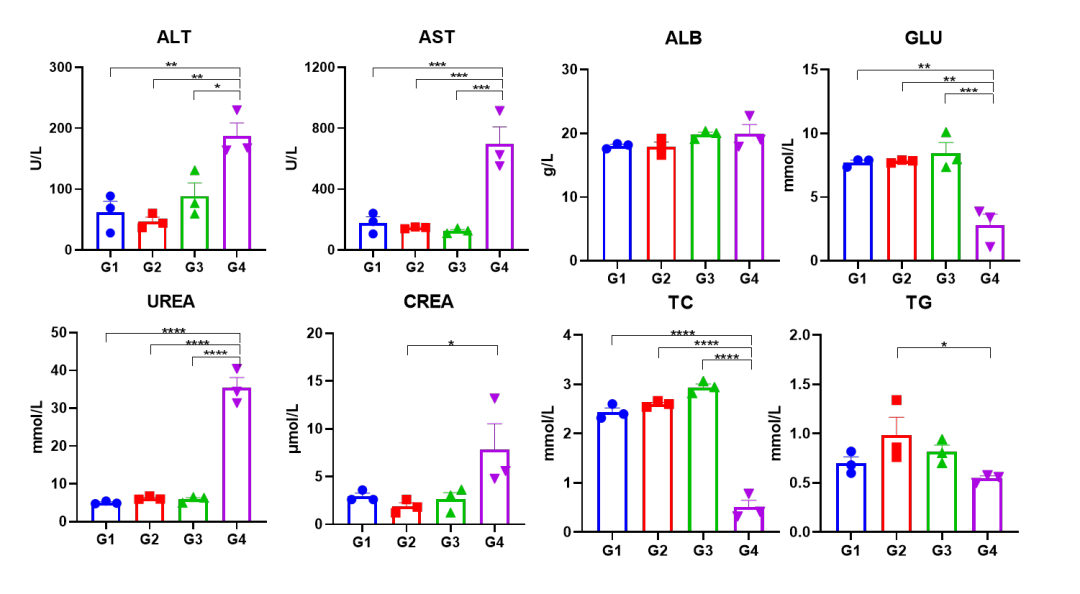
将野生型C57BL/6小鼠和同源B-hCRBN小鼠分为两组(n=3),每组腹腔注射5 mg/kg CC-885(HY-101488)或溶媒对照。 所有组小鼠在第二次注射后 6 小时安乐死采血,并测量血液生化数据(BBD)。 Notes:*p<0.05,**p<0.01,***p<0.001,****p<0.0001.
随着PROTACs和分子胶向实体瘤、神经退行性疾病等领域拓展,构建安全性评价体系已成为行业刚需。以B-hCRBN模型为代表的人源化工具,正推动靶向蛋白降解从实验室奇迹走向更安全、更可控的临床治疗新时代。
参考资料
[1] Yamamoto, J., Ito, T., Yamaguchi, Y. and Handa, H. (2022). Discovery of CRBN as a target of thalidomide: a breakthrough for progress in the development of protein degraders. Chemical Society Reviews, [online] 51(15), pp.6234–6250. doi:https://doi.org/10.1039/D2CS00116K.
[2] Screening for molecular glues – Challenges and opportunitiesHoldgate, Geoffrey A. et al.SLAS Discovery, Volume 29, Issue 2, 100136
[3] Dale, B., Cheng, M., Park, K.-S., Kaniskan, H.Ü., Xiong, Y. and Jin, J. (2021). Advancing targeted protein degradation for cancer therapy. Nature Reviews Cancer, 21(10), pp.638–654. doi:https://doi.org/10.1038/s41568-021-00365-x.
[4] He, J., Guo, J., Liu, S., Li, H., Ma, Y., Ma, S., Hu, Z., Zhao, W., Tan, M., Liu, W. and Liu, B. (2025). Targeted degradation of GOLM1 by CC-885 via CRL4-CRBN E3 ligase inhibits hepatocellular carcinoma progression. Cellular Signalling, 130, p.111665. doi:https://doi.org/10.1016/j.cellsig.2025.111665.