

당신도 좋아할 수 있습니다
近年来,神经系统疾病(Neurological Disorders)发病率持续攀升,已成为全球性重大公共卫生挑战。该类疾病累及中枢或外周神经系统的多个层面(如大脑、脊髓、外周神经、神经肌肉接头及肌肉组织),涵盖神经退行性疾病[阿尔茨海默病(Alzheimer’s Disease, AD)、帕金森病(Parkinson’s Disease, PD)、肌萎缩侧索硬化症(Amyotrophic Lateral Sclerosis, ALS)]、神经精神疾病[抑郁症(Depression)、精神分裂症(Schizophrenia)]及慢性疼痛[如偏头痛(Migraine)]等,是全球致残首要诱因之一。伴随人口老龄化加剧,AD、PD、ALS等神经退行性疾病的流行病学负担日趋严峻,造成沉重的社会经济压力。

图1:1990–2021年中国神经系统疾病负担的变化趋势与区域差异[1]
神经系统疾病分类及治疗挑战
神经系统疾病普遍具有发病机制复杂、治疗周期长、个体异质性显著等特点,药物研发面临多重壁垒:
1.血脑屏障限制药物递送效力,显著降低中枢靶向治疗的可及性。
2.病理机制呈高度网络化(如病理性蛋白异常聚集、突触功能障碍、蛋白质稳态失衡、神经元能量代谢失调、神经炎症级联反应及细胞凋亡等),多通路交互作用导致单一靶点干预效果有限。
3.关键治疗靶点尚未完全解析,制约精准疗法的开发[2]。上述因素共同致使神经系统药物研发成功率远低于其他疾病领域。当前传统药物治疗方案普遍存在疗效局限,亟需构建精准疾病模型、革新药理药效评价体系,以突破研发瓶颈并推动新型治疗策略的临床转化。
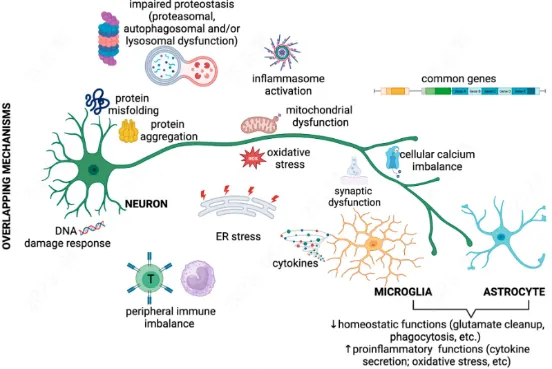
图2:神经退行性病变关键病理机制[2]
神经系统药物研发新进展
近年来,神经系统药物研发取得了多项突破性进展:在神经退行性疾病领域,随着对发病机制的深入理解,治疗策略也从单一的对症治疗,逐步迈向靶向病理蛋白的精准干预,如2023年FDA批准的Lecanemab作为抗Aβ单克隆抗体,为AD的治疗带来新希望[3]。PD治疗方面,靶向α-突触核蛋白(α-synuclein, α-syn)的疫苗和单克隆抗体的免疫疗法取得重要进展,如处于II期临床的AFFITOPE®PD01A和PD03A疫苗通过主动免疫疗法诱导机体产生特异性抗体;已进入III期临床的Prasinezumab抗体通过被动免疫直接中和致病性α-syn聚集体。这些疗法通过不同机制靶向异常聚集的α-突触核蛋白,展现出良好的治疗前景[4]。针对ALS,Tofersen作为SOD1靶向的反义寡核苷酸药物已获批用于特定患者群体,显示出延缓疾病进展的趋势,并具有良好的安全性[5]。
神经精神疾病治疗领域正经历范式转变的革命性浪潮,如新一代快速起效抗抑郁药物(如作用于谷氨酸能系统的Spravato(艾司氯胺酮)鼻喷剂)正逐步替代传统的5-HT靶点疗法[6];同时,精准治疗范式的加速发展推动着靶向神经炎症、小胶质细胞活化等新兴机制的疗法进入临床探索阶段。基因疗法在神经肌肉疾病治疗领域也取得显著突破——如利用AAV9载体递送功能性SMN1基因的Zolgensma显著改善了脊髓性肌萎缩症(Spinal Muscular Atrophy, SMA)患儿的运动功能预后[7];而基于外显子跳跃技术(Exon hopping therapy)的反义寡核苷酸药物(如Casimersen)则为特定基因突变的杜氏肌营养不良症(Duchenne muscular dystrophy, DMD)患者提供了高度精准的治疗策略[8]。此外,疼痛管理领域亦同步迈进,特异性Nav1.8电压门控钠通道抑制剂VX-548在急性疼痛治疗中疗效显著,有效规避了传统阿片类药物的成瘾性风险[9];对TRPV1、P2X3受体等新靶点的持续探索正在拓展疼痛干预的新路径;CGRP靶向单克隆抗体(如Erenumab)则已确立为偏头痛预防的一线标准治疗[10]。
神经系统疾病临床前动物模型
构建高质量、可重复性强的动物模型,是解析神经系统疾病发病机制、验证药物靶点及评估神经药物疗效的关键基础。基于基因编辑技术平台,百奥赛图自主研发并系统优化了覆盖经典与创新模式的动物模型体系,全面满足神经系统疾病研究的多元化需求。同时,配套构建了包含两大主要功能模块的标准化行为学检测平台:
01、感觉与运动功能评估系统
旷场实验(Open Field Test)、转棒疲劳实验(Rotarod Test)、抓力测试(Grip Strength Test)等运动功能检测,圆筒实验(Cylinder Test)、步态分析(Gait analysis)等运动协调性分析以及机械痛觉测试(Von Frey Test)、热痛觉测试(Hot Plate Test及Tail Flick Test)等痛觉敏感性检测
02、情感与认知功能评估系统
高架十字迷宫(Elevated Plus Maze Test)、糖水偏好测试(Sucrose Preference Test)、悬尾测试(Tail Suspension Test)、强迫游泳(Forced Swimming Test)等焦虑抑郁样行为检测,三箱社交实验(Three-Chamber Social Test)、新物体识别(Novel Object Recognition Test)、Y迷宫(Y-Maze Test)、水迷宫(Morris Water Maze Test)和条件恐惧记忆(Fear Conditioning Test)等学习记忆及认知功能能力检测
该集成化平台可实现对动物多维行为表型的系统性量化分析(图3-6)。
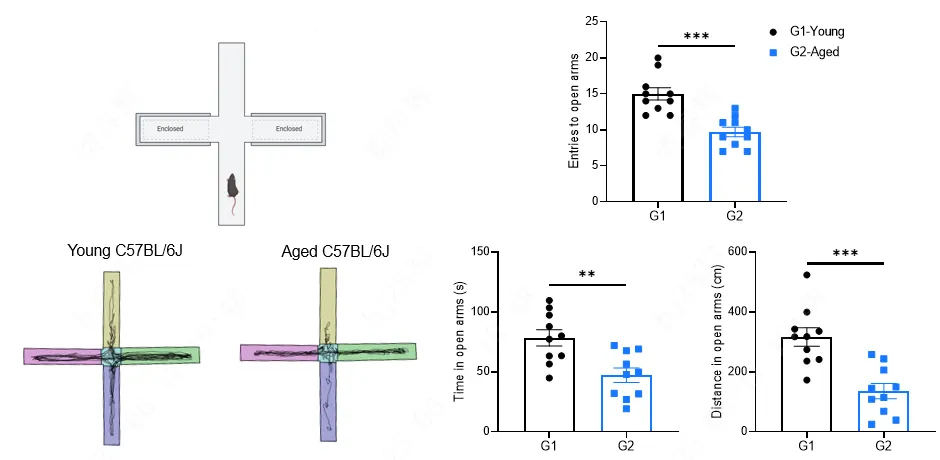
图3:老年小鼠(18月龄)小鼠高架十字迷宫测试
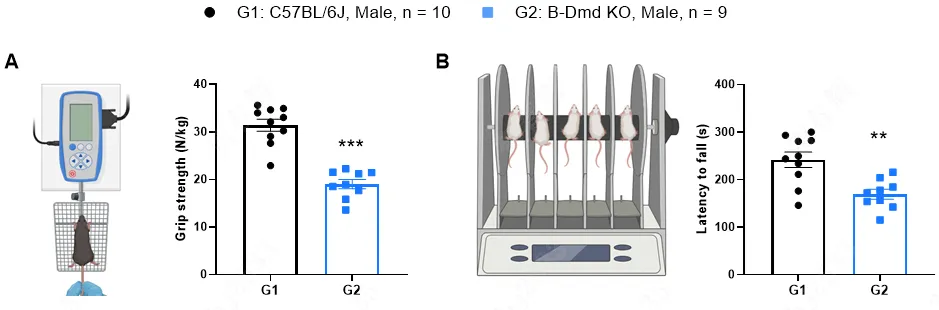
图4:杜氏肌营养不良B-Dmd KO小鼠运动功能评价。(A)抓力测试。(B)转棒疲劳实验。
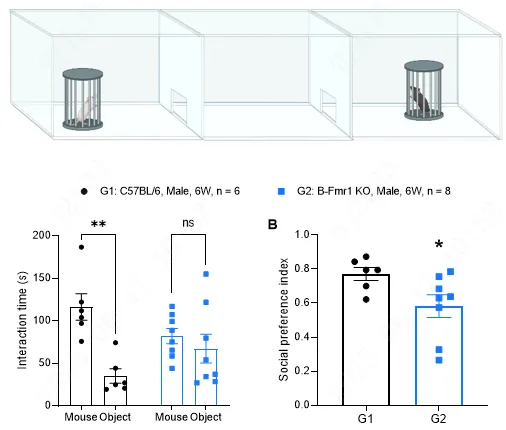
图5:自闭症谱系障碍(Autism Spectrum Disorder)B-Fmr1 KO 小鼠三箱社交测试

图6: C57BL/6小鼠足底切口痛手术模型
此外,百奥赛图团队还建立了与神经疾病相关生物标志物的组织病理学检测体系以及神经炎症标志物的检测等,为神经系统疾病的机制研究与药效验证提供了有力的支持(图7)。
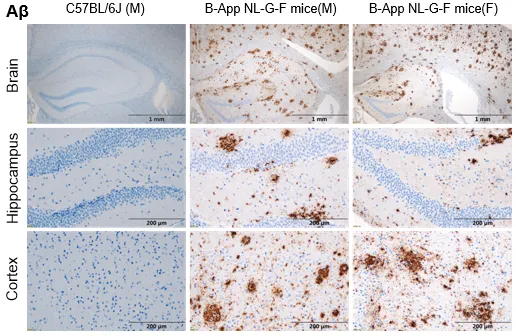
图7:阿尔兹海默症B-App NL-G-F小鼠相关生物标志物的组织病理学检测
虽然神经系统疾病的研究和治疗仍面临诸多挑战,但抗体疗法、基因编辑和多组学技术正开启精准干预的新纪元,而高质量疾病模型的构建为机制解析和治疗开发提供了关键平台。总之,从实验室到临床的每一次突破,都在推动我们跨越"死亡之谷",向着"神经健康平等化"的未来迈进——让科学的光芒照亮每位患者的生命。
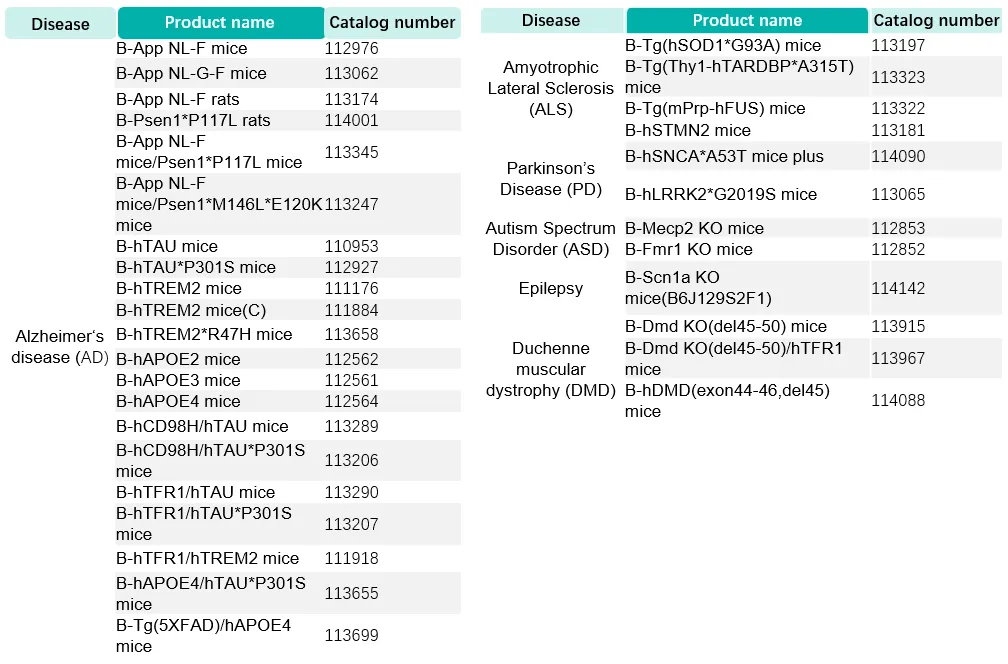
百奥赛图神经相关靶点人源化小鼠列表(部分展示)
参考文献:
[1] Zhang C, Yang X, Wan D, Ma Q, Yin P; GBD 2021 China Neurological Disorders Collaborators; Zhou M, Hao J. Burden of neurological disorders in China and its provinces, 1990-2021: Findings from the global burden of disease study 2021. Med. 2025 May 1:100692. doi: 10.1016/j.medj.2025.100692. Epub ahead of print. PMID: 40315853.
[2] Angeloni, C.; Malaguti, M.; Prata, C.; Freschi, M.; Barbalace, M.C.; Hrelia, S. Mechanisms Underlying Neurodegenerative Disorders and Potential Neuroprotective Activity of Agrifood By-Products. Antioxidants 2023, 12, 94.
[3] van Dyck CH, Swanson CJ, Aisen P, Bateman RJ, Chen C, Gee M, Kanekiyo M, Li D, Reyderman L, Cohen S, Froelich L, Katayama S, Sabbagh M, Vellas B, Watson D, Dhadda S, Irizarry M, Kramer LD, Iwatsubo T. Lecanemab in Early Alzheimer's Disease. N Engl J Med. 2023 Jan 5;388(1):9-21. doi: 10.1056/NEJMoa2212948. Epub 2022 Nov 29. PMID: 36449413.
[4] Alfaidi M, Barker RA, Kuan WL. An update on immune-based alpha-synuclein trials in Parkinson's disease. J Neurol. 2024 Dec 12;272(1):21.
[5] Miller TM, Cudkowicz ME, Genge A, Shaw PJ, Sobue G, Bucelli RC, Chiò A, Van Damme P, Ludolph AC, Glass JD, Andrews JA, Babu S, Benatar M, McDermott CJ, Cochrane T, Chary S, Chew S, Zhu H, Wu F, Nestorov I, Graham D, Sun P, McNeill M, Fanning L, Ferguson TA, Fradette S; VALOR and OLE Working Group. Trial of Antisense Oligonucleotide Tofersen for SOD1 ALS. N Engl J Med. 2022 Sep 22;387(12):1099-1110. doi: 10.1056/NEJMoa2204705. PMID: 36129998.
[6] Marwaha S, Palmer E, Suppes T, Cons E, Young AH, Upthegrove R. Novel and emerging treatments for major depression. Lancet. 2023 Jan 14;401(10371):141-153. doi: 10.1016/S0140-6736(22)02080-3. Epub 2022 Dec 16. PMID: 36535295.
[7] Ogbonmide T, Rathore R, Rangrej SB, Hutchinson S, Lewis M, Ojilere S, Carvalho V, Kelly I. Gene Therapy for Spinal Muscular Atrophy (SMA): A Review of Current Challenges and Safety Considerations for Onasemnogene Abeparvovec (Zolgensma). Cureus. 2023 Mar 15;15(3):e36197. doi: 10.7759/cureus.36197. PMID: 37065340; PMCID: PMC10104684.
[8] Assefa M, Gepfert A, Zaheer M, Hum JM, Skinner BW. Casimersen (AMONDYS 45™): An Antisense Oligonucleotide for Duchenne Muscular Dystrophy. Biomedicines. 2024 Apr 20;12(4):912. doi: 10.3390/biomedicines12040912. PMID: 38672266; PMCID: PMC11048227.
[9] Jones J, Correll DJ, Lechner SM, Jazic I, Miao X, Shaw D, Simard C, Osteen JD, Hare B, Beaton A, Bertoch T, Buvanendran A, Habib AS, Pizzi LJ, Pollak RA, Weiner SG, Bozic C, Negulescu P, White PF; VX21-548-101 and VX21-548-102 Trial Groups. Selective Inhibition of NaV1.8 with VX-548 for Acute Pain. N Engl J Med. 2023 Aug 3;389(5):393-405. doi: 10.1056/NEJMoa2209870. PMID: 37530822.
[10] Goadsby PJ, Reuter U, Hallström Y, Broessner G, Bonner JH, Zhang F, Sapra S, Picard H, Mikol DD, Lenz RA. A Controlled Trial of Erenumab for Episodic Migraine. N Engl J Med. 2017 Nov 30;377(22):2123-2132. doi: 10.1056/NEJMoa1705848. PMID: 29171821.