

이 페이지에서
항체-약물 결합체 (ADC)는 특정 종양 항원을 인식하는 모노클로날 항체, 매우 강력한 세포독성 약물인 페이로드, 페이로드와 항체를 연결하는 링커로 구성되어 있으며, 모노클로날 항체의 특이성을 활용하여 항원을 발현하는 종양 세포에 선택적으로 세포독성 약물을 전달하는 것을 목표로 하고 있습니다. 최근 ADC는 미래의 질병 치료의 중요한 수단으로 여겨지며, 그 세계적 확산이 급증하고 있습니다.
당사는 강력한 in vivo 및 in vitro 플랫폼을 바탕으로 ADC 및 기타 항암 치료와 병용 전략을 위한 전임상 연구를 위한 최첨단 ADC 평가 플랫폼을 확립하였습니다.
당사의 흐름 세포 측정법 및 세포 기반 플랫폼은 항체 친화도 및 결합, 내부화 과정, 페이로드의 효능 (세포자살 및 세포 주기), 항체 조각의 효능 (ADCC, CDC, ADCP) 평가를 포함한 빠르고 신뢰할 수 있으며 재현 가능한 in vitro 연구를 지원합니다. in vivo ADC 평가를 위해 당사의 경험이 풍부한 팀과 광범위한 CDX 모델 컬렉션은 ADC 및 병용 치료의 효율적인 효과 평가를 촉진합니다. 또한 당사는 독성 연구에 사용할 수 있는 TAA 타겟 인간화 마우스 모델을 연속적으로 개발했습니다. 또한 당사는 ADC 개발에 특화된 항원 특이적 과잉 발현 또는 노크인 세포주를 맞춤화하는 데 전문화되어 있습니다.
| Projects | Experiments | Methods | ||
| Binding Assays | Target Antigen Binding (Same Family) | Binding activity detection | SPR/BLI | OK |
| Target Antigen Cross-Binding(Human, Mouse, Monkey) | Binding activity detection | SPR/BLI | OK | |
| FcRn Binding | Binding activity detection | SPR/BLI | OK | |
| FcγR Receptor Family Binding | Binding activity detection | SPR/BLI | OK | |
| C1q Binding | Binding activity detection | ELISA | OK | |
| Functional Studies (in vitro) |
Cell screening | Protein expression detection | Flow cytometry, IHC | OK |
| Antibody binding | Antibody concentration titration | Flow cytometry | OK | |
| Cytotoxicity | Proliferation inhibition | CTG, Prestoblue, IncuCyte | OK | |
| Bystander effect | Flow cytometry, Incucyte | OK | ||
| Mechanistic research | Antibody endocytosis | Flow cytometry, Incucyte, Confocal | OK | |
| Apoptosis | Flow cytometry, Incucyte | OK | ||
| Cell Cycle | Flow cytometry | OK | ||
| ADCC, CDC, ADCP | Flow cytometry, LDH, CTG, Prestoblue | OK | ||
| Lysosome Co-localization | confocal | OK | ||
| Ligand Blocking | Flow cytometry | OK | ||
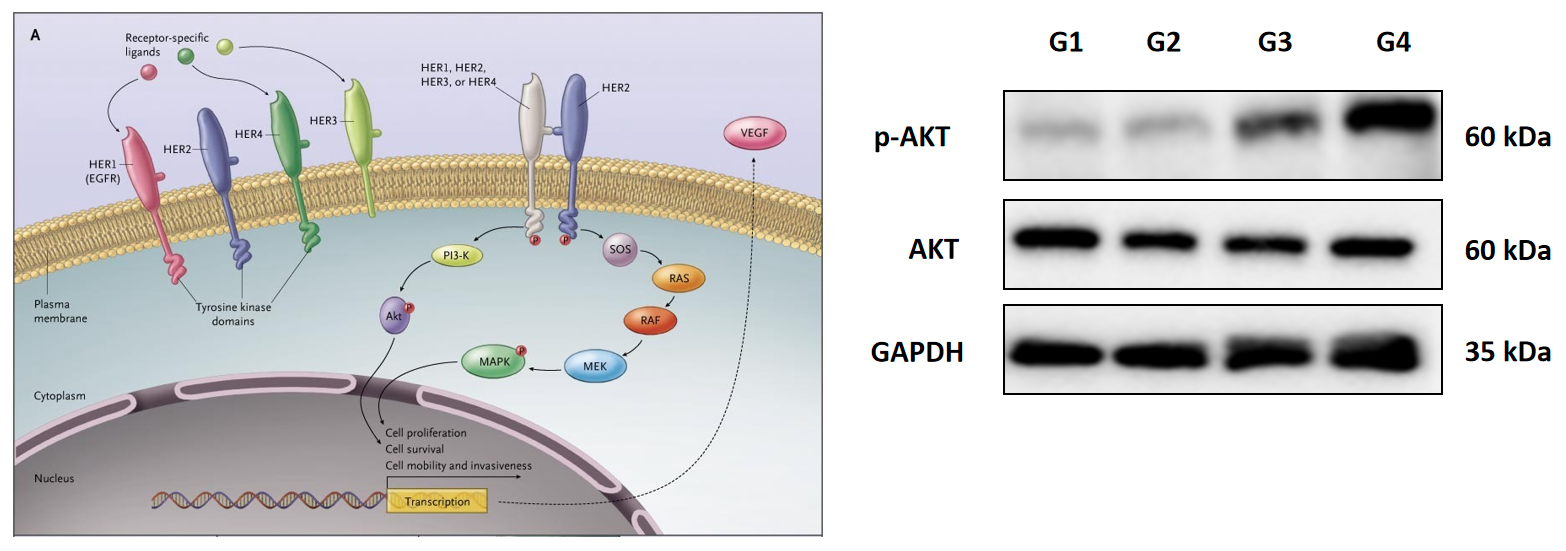
| Signaling pathways | Western Blot, MSD … | OK | ||
| Pharmacokinetics (ex vivo) |
Stability | Test stability of ADC in plasma (Human, Mouse, Monkey) | LC-MS | OK |
| PK Profile | Serum concentration monitoring | ELISA, MSD | OK | |
| Efficacy Studies (in vivo) |
Anti-tumor efficacy | CDX model | Tumor volume | OK |
| PDX model | Tumor volume | OK | ||
| Orthotopic model | Bioluminescence | OK | ||
| Bystander effect | Bioluminescence | OK | ||
| Tissue distribution | ELISA, MSD | Developing |
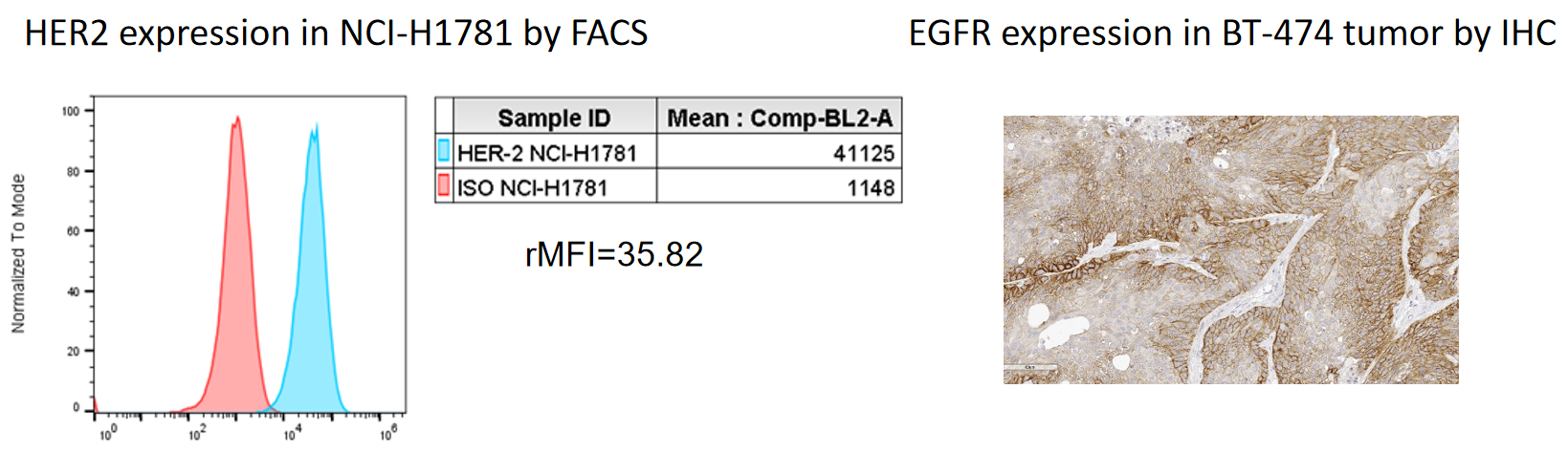
종양 세포주에서 Trop2 발현의 절대 정량
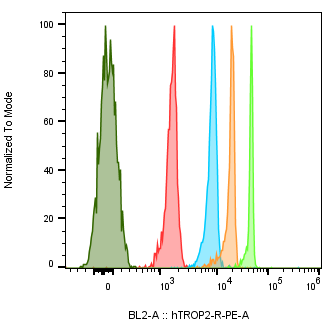
| Cell Line Name | Trop2 Expression level (/cell) |
| NCI-N87 | 667,835 |
| A431 | 3,816,803 |
| MCF-7 | 445,552 |
| NCI-H292 | 1,375,075 |
| NCI-H520 | 822 |
| NCI-H1975 | 401,381 |
| HCC827 | 821,464 |
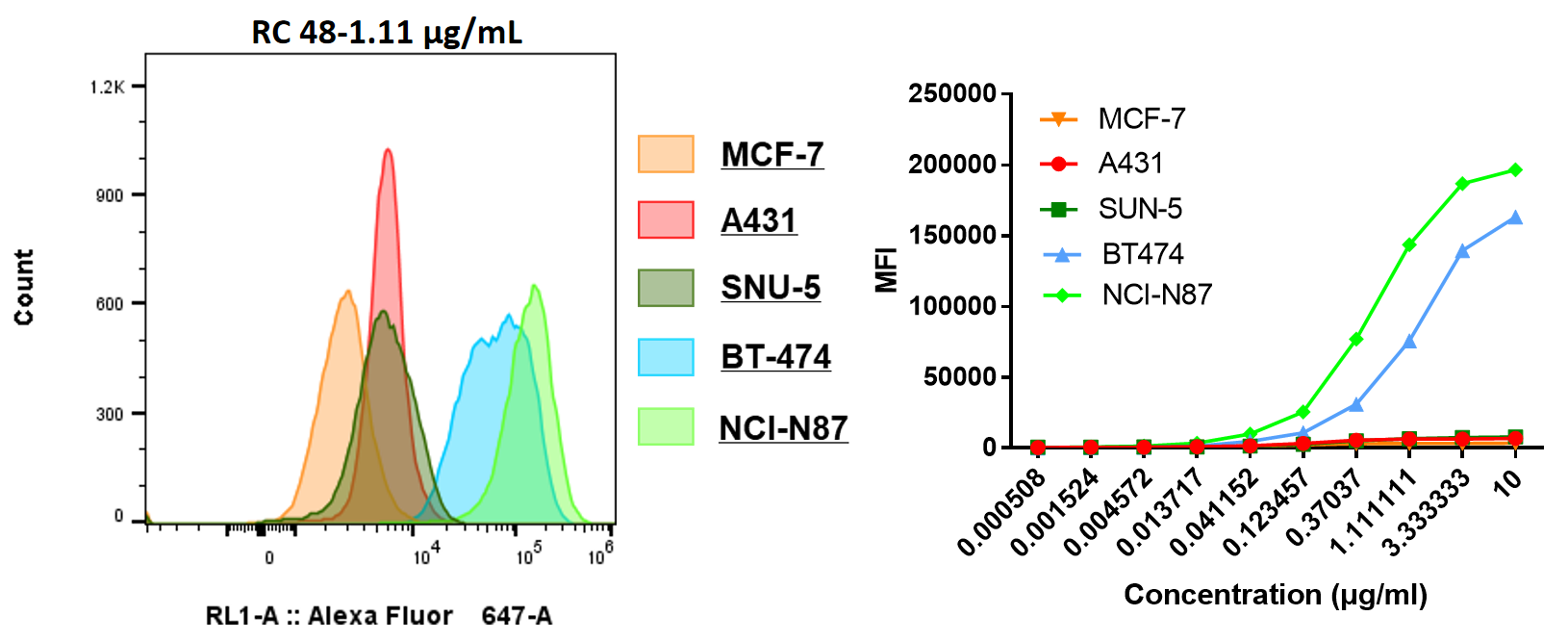
| EC50 (μg/mL) | |
| NCI-N87 | 0.511 |
| MCF-7 | - |
| BT474 | 1.042 |
| SNU-5 | - |
| A431 | - |
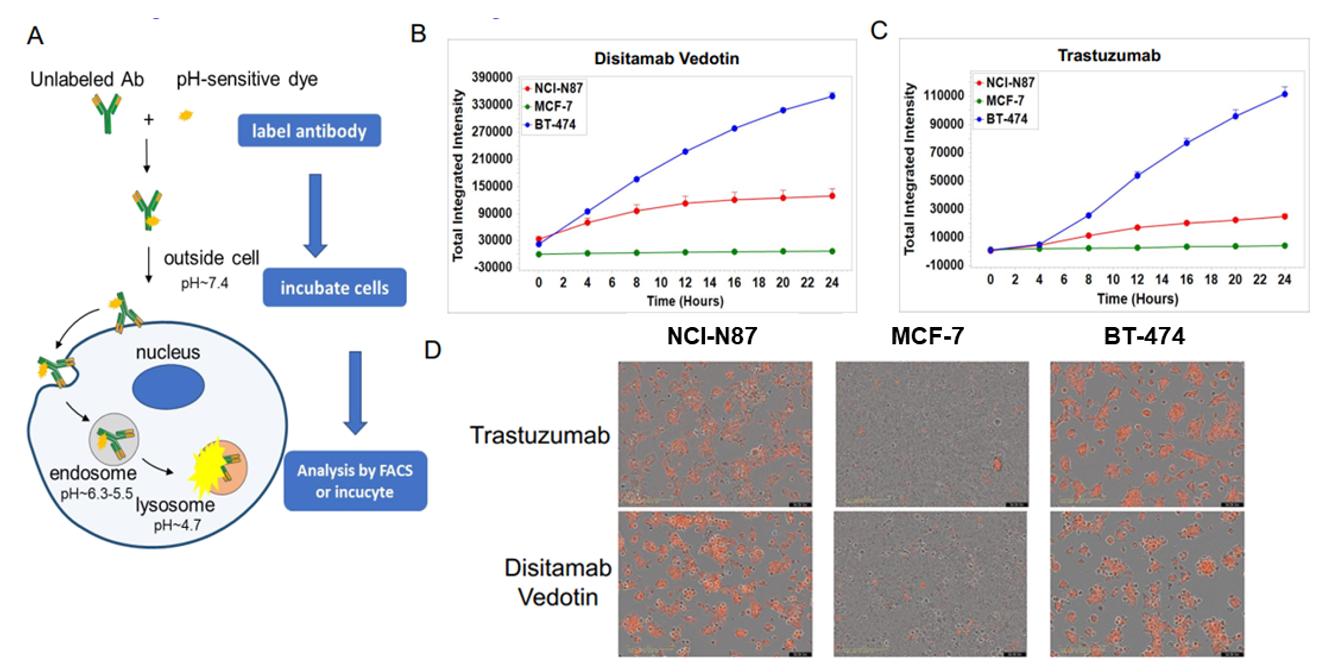
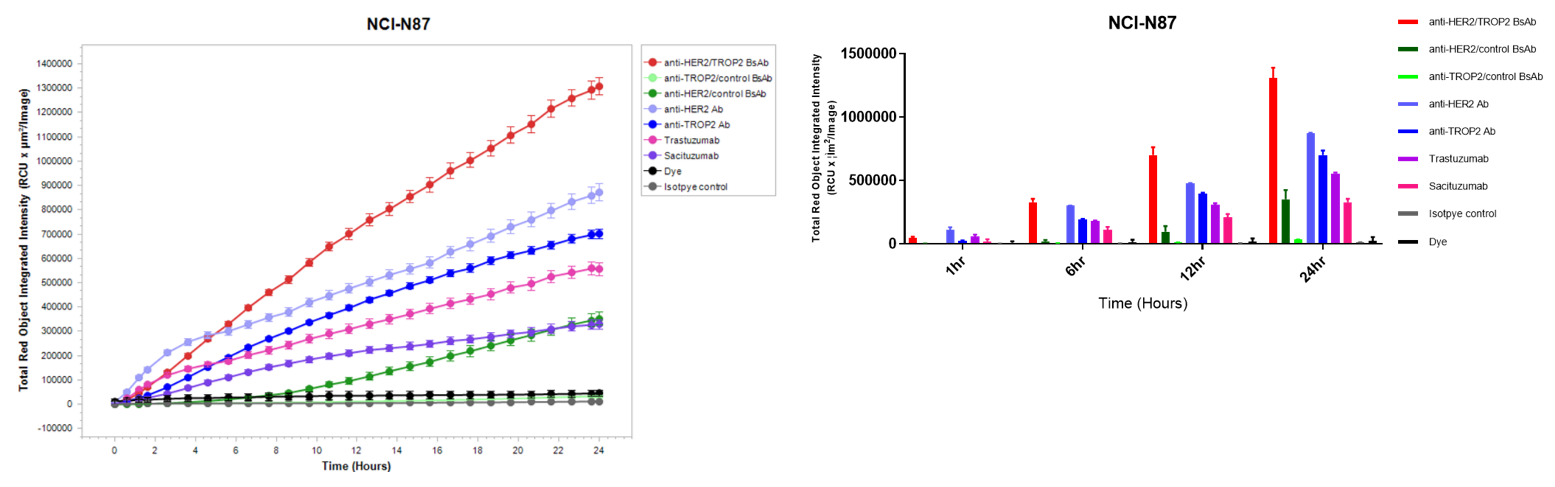
in vitro 세포 내 흡수 실험: Disitamab Vedotin 및 trastuzumab. A: 항체 세포 내 흡수 실험의 개념도. NCI-N87, MCF-7, BT-474 세포를 pH 민감 형광 염료로 표지된 Disitamab Vedotin (RC-48) 또는 trastuzumab과 24시간 배양한 후 Incucyte로 지속적으로 관찰했습니다. B-C: 세포 내 항체 수치를 나타내는 수직 축. D: 사진에서 주황색 신호는 세포 내 흡수된 항체를 나타냅니다. Disitamab Vedotin (RC-48)과 trastuzumab은 NCI-N87과 BT-474 세포에서 시간 의존적으로 세포 내 흡수되었으며, MCF-7 세포에서는 흡수가 관찰되지 않았습니다.
| gene_name | FPKM NCI_N87 |
| HER2 | 1444 |
| TROP2 | 761 |
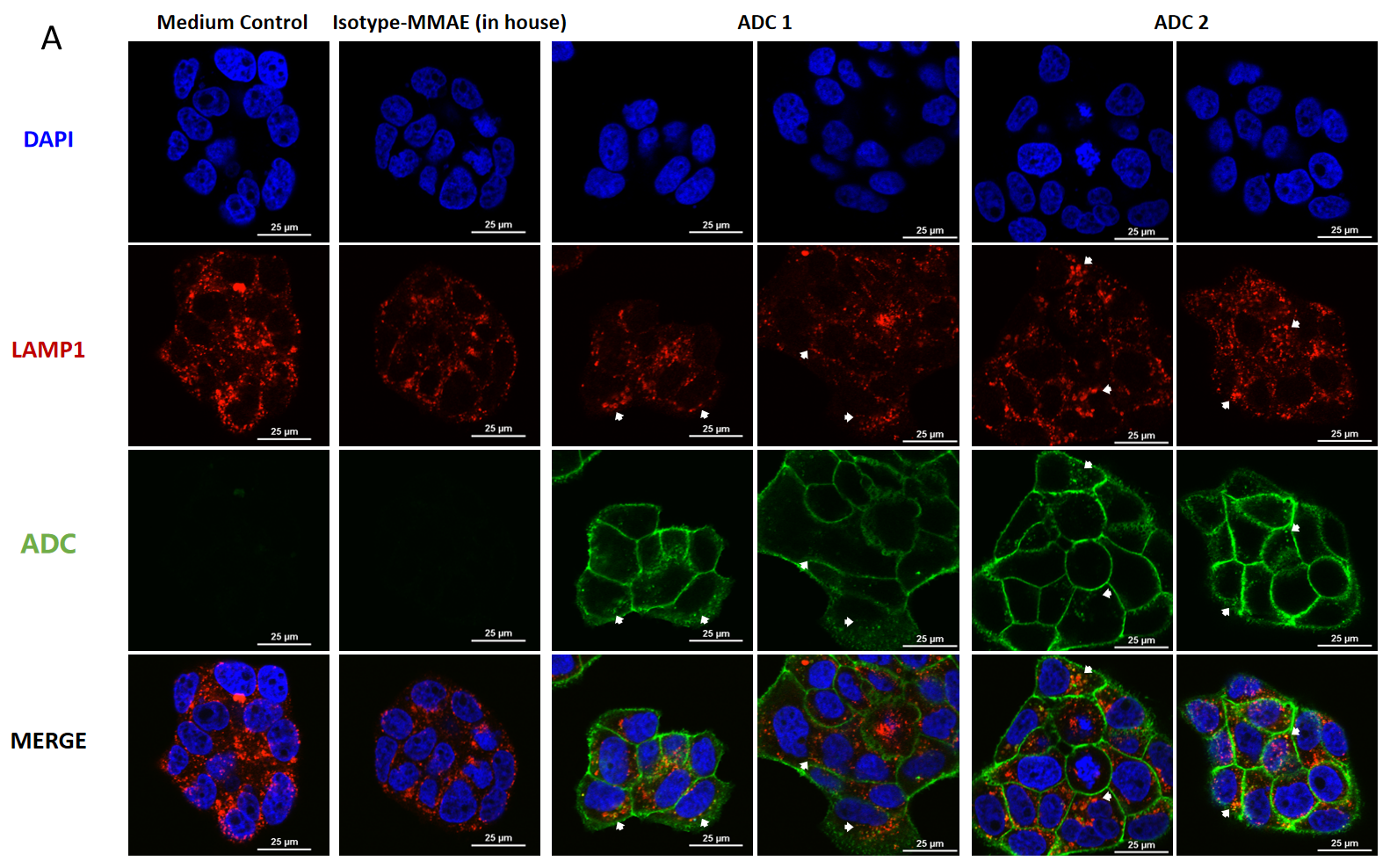
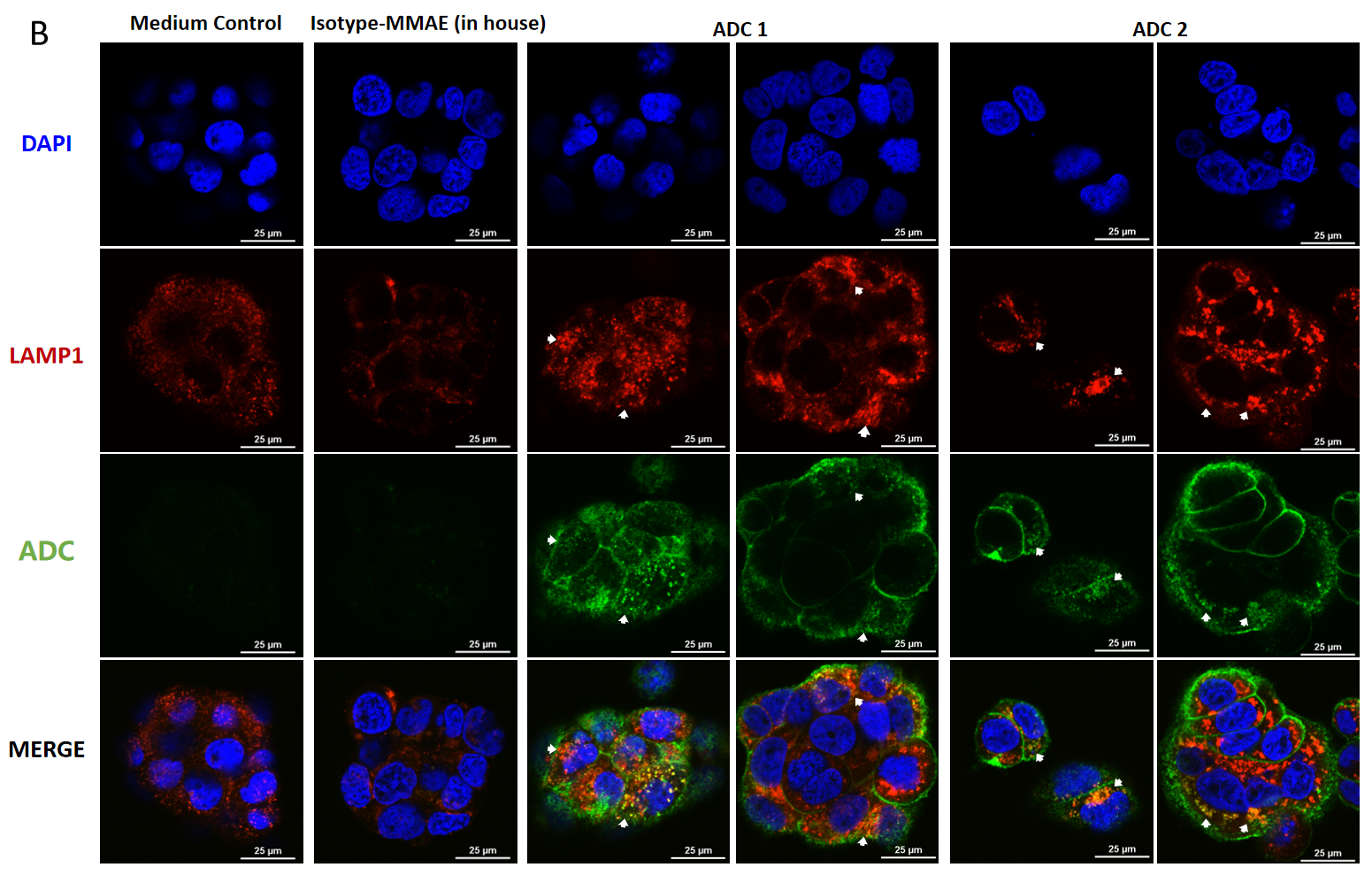
BT474 (Her2+ 및 Trop2+) 세포의 공초점 현미경 이미지, MMAE 결합 ADC의 세포 내 흡수 및 리소좀 전송.
BT474 세포는 ADC 처리 후 (A) 4시간과 (B) 24시간 후 (각 ADC 10 μg/mL), FITC로 표지된 양모 항히토 IgG 항체(녹색)로 염색되었습니다. 리소좀은 LAMP1 마우스 단클론 항체와 Cy3로 표지된 양모 항마우스 IgG 2차 항체(빨간색)로 염색되었고, 세포 핵은 DAPI(파란색)로 염색되었습니다. 축척: 25μm.
| MDA-MB-468: BT474 | ||
| 0:1 | 1:0 | 1:1 |
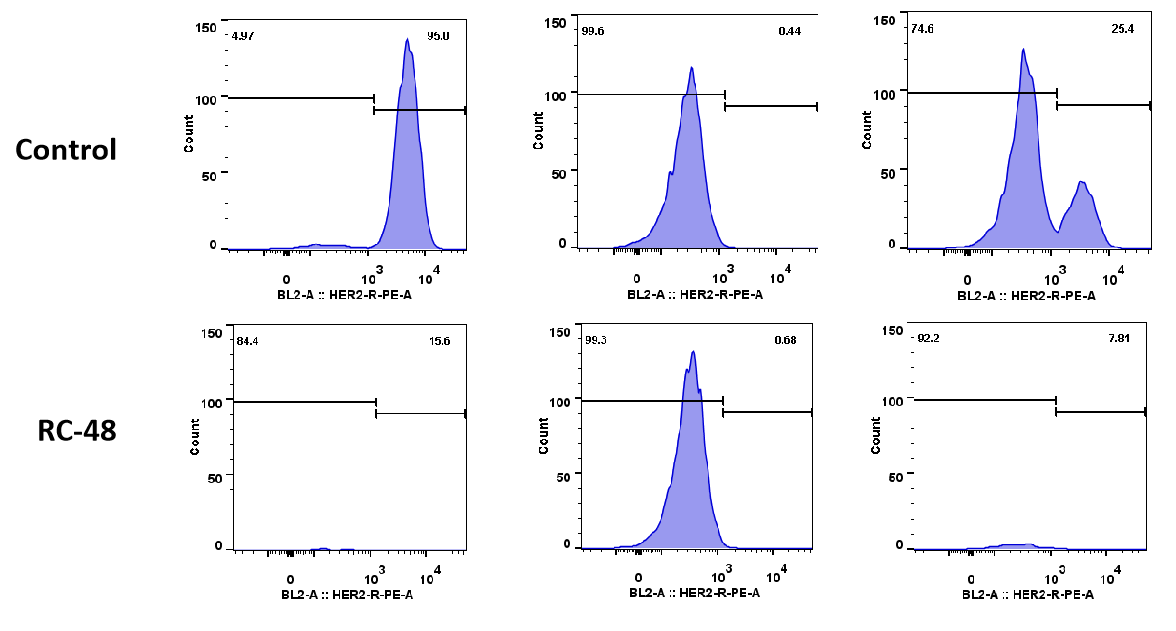
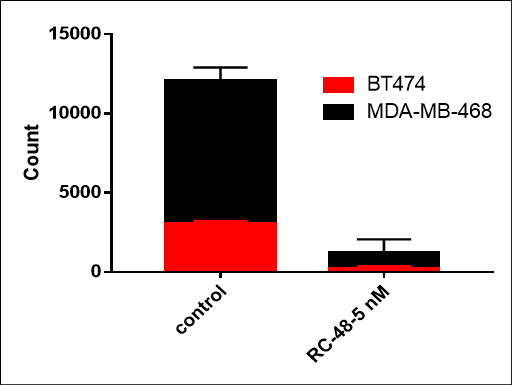
MDA-MB-468 세포(Her2-)와 BT474(Her2+) 세포를 서로 다른 비율(각각 0:1, 1:0, 1:1)로 혼합하여 하룻밤 배양했습니다. RC48 또는 대조군으로 5일간 처리한 후, 세포 수와 Her2 양성 및 Her2 음성 세포 비율을 흐름 세포 분석기로 측정했습니다. RC48은 BT474 세포에 대해 탁월한 종양 세포 살상 효과를 나타내었고, MDA-MB-468 세포에는 거의 독성이 없었습니다. 중요한 것은, RC48이 BT474 세포와 공동 배양될 때 MDA-MB-468 세포도 살상할 수 있다는 것입니다.
| B-CAG-luc-GFP KI, EGFR KO BxPC-3: BxPC-3 | ||
| 1:1 | 1:0 | 0:1 |
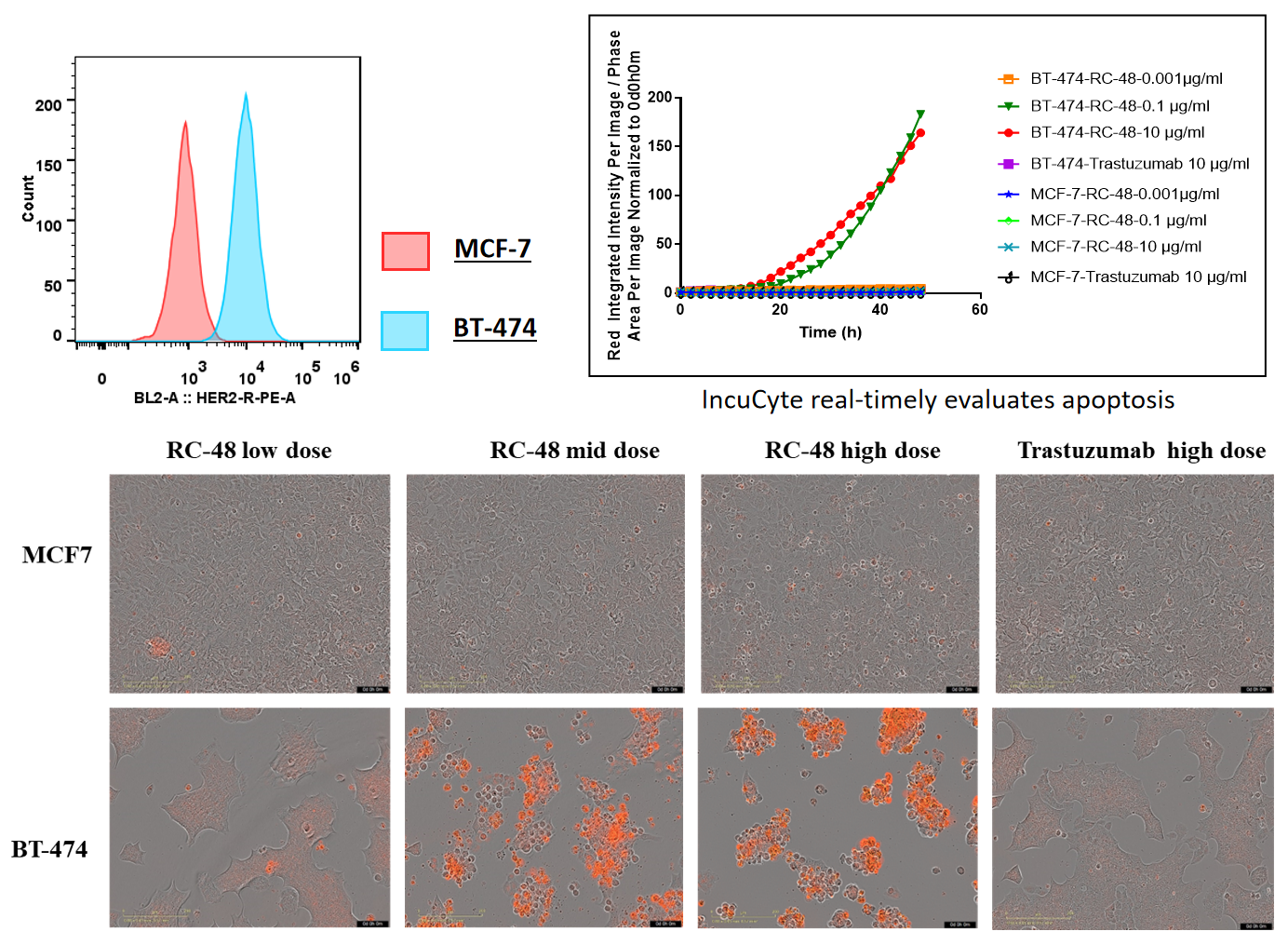
BT-474 (Her2+) 및 MCF7 (Her2-) 세포를 다양한 농도의 trastuzumab 또는 RC48으로 72시간 처리한 후, Sartorius IncuCyte Caspase-3/7 적색 세포 사멸 키트를 사용하여 세포 사멸을 측정했습니다. 적색 신호는 활성화된 Caspase 3/7을 나타냅니다. RC48 (중고 용량)은 BT-474에서 세포 사멸을 유의미하게 촉진했으나, trastuzumab에서는 나타나지 않았습니다. 또한 MCF7 세포에서는 처리 후 세포 사멸이 관찰되지 않았습니다.
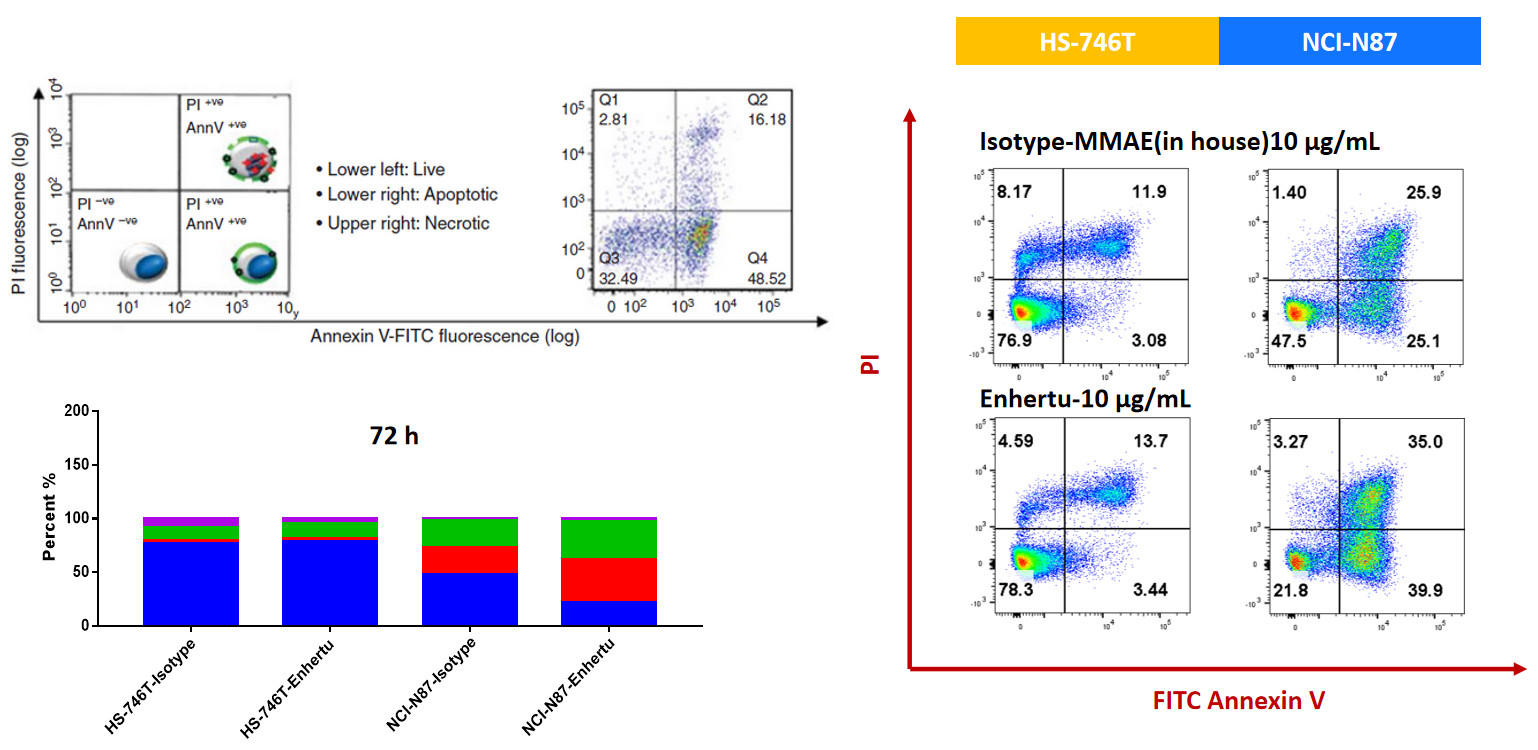
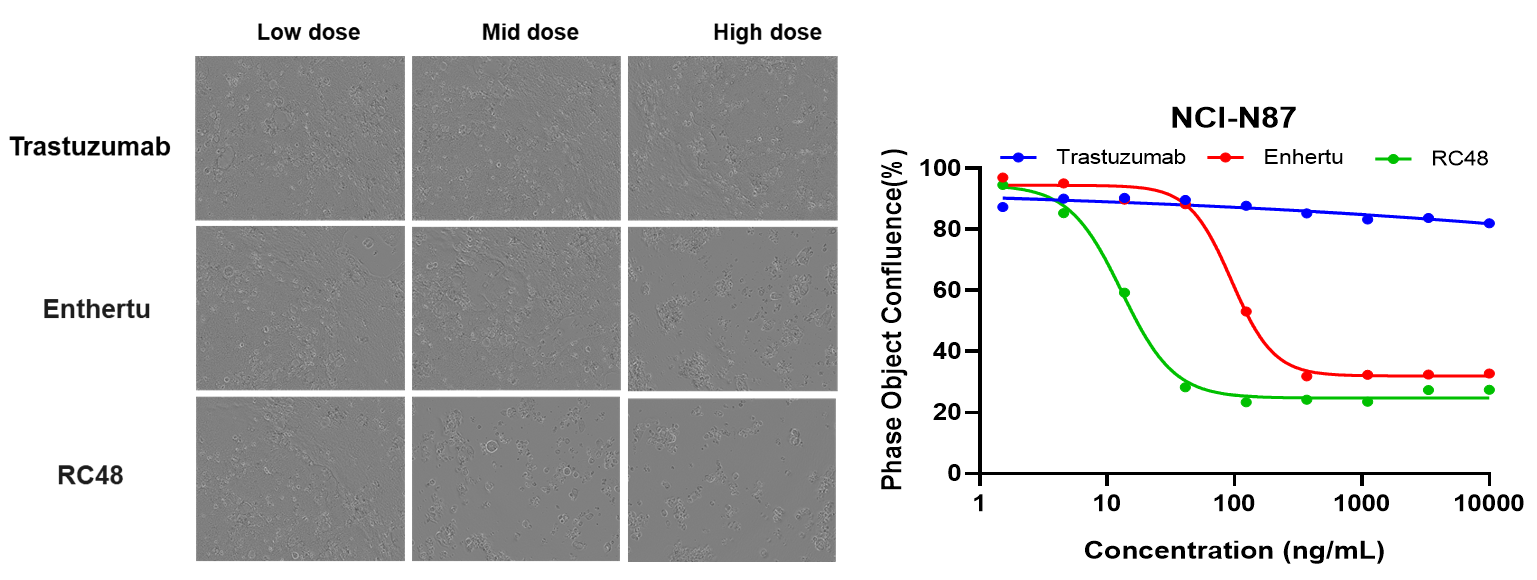
NCI-N87 (Her2+) 및 HS-746T (Her2-) 세포를 ISO-MMAE 및 Enthertu로 72시간 처리한 후, 세포 사멸을 Annexin V/PI 키트와 흐름 세포 분석기로 측정했습니다. Her2 높은 발현을 가진 NCI-N87에서, Enthertu는 세포 사멸을 유의미하게 유도했습니다.
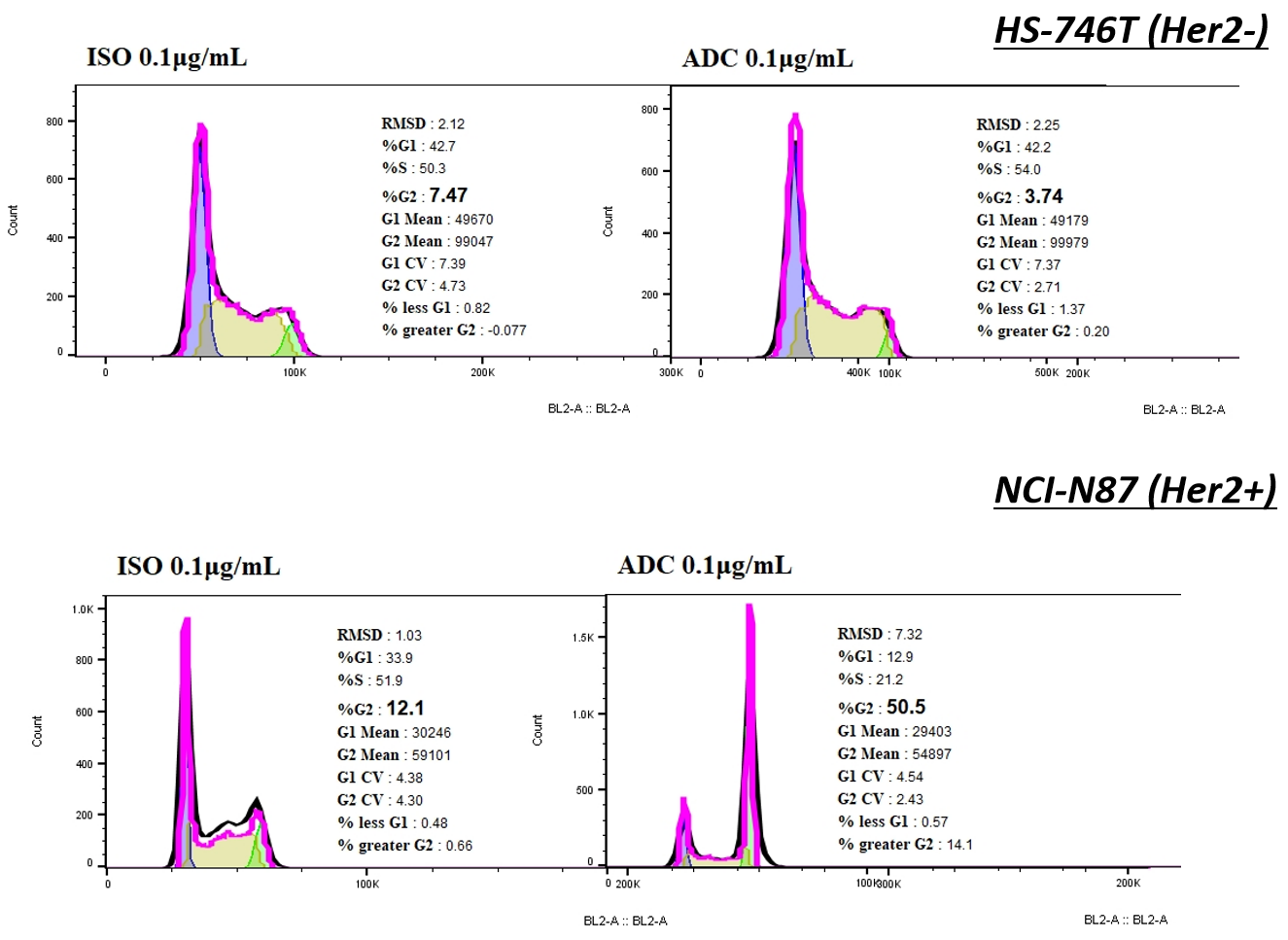
ISO-MMAE와 비교하여, Her2-MMAE는 NCI-N87에서 세포 주기 정지를 일으키며, G2/M기 세포 비율이 급격히 증가했으나, HS-746T 세포에서는 관찰되지 않았습니다.
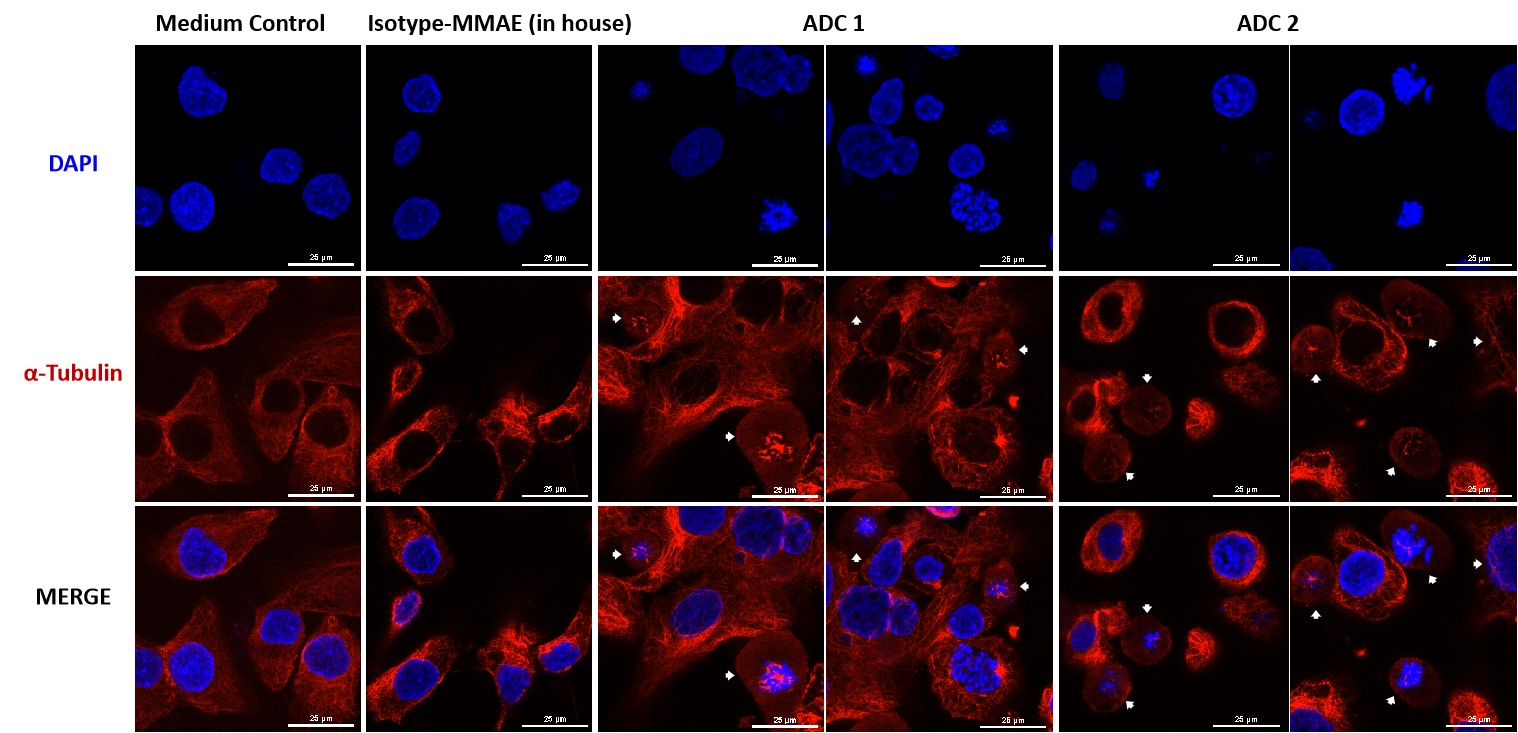
MMAE 결합 ADC가 공초점 현미경으로 세포 내 미세소관 네트워크를 파괴하는 모습을 관찰.
SKOV-3 (Her2+ 및 Trop2+) 세포는 MMAE 결합 ADC로 24시간 (각 ADC 10 μg/mL) 처리되었습니다. 미세소관은 PE로 표지된 α-Tubulin 마우스 단클론 항체(빨간색)로 염색되었고, 세포 핵은 DAPI (파란색)로 염색되었습니다. 축척: 25μm.
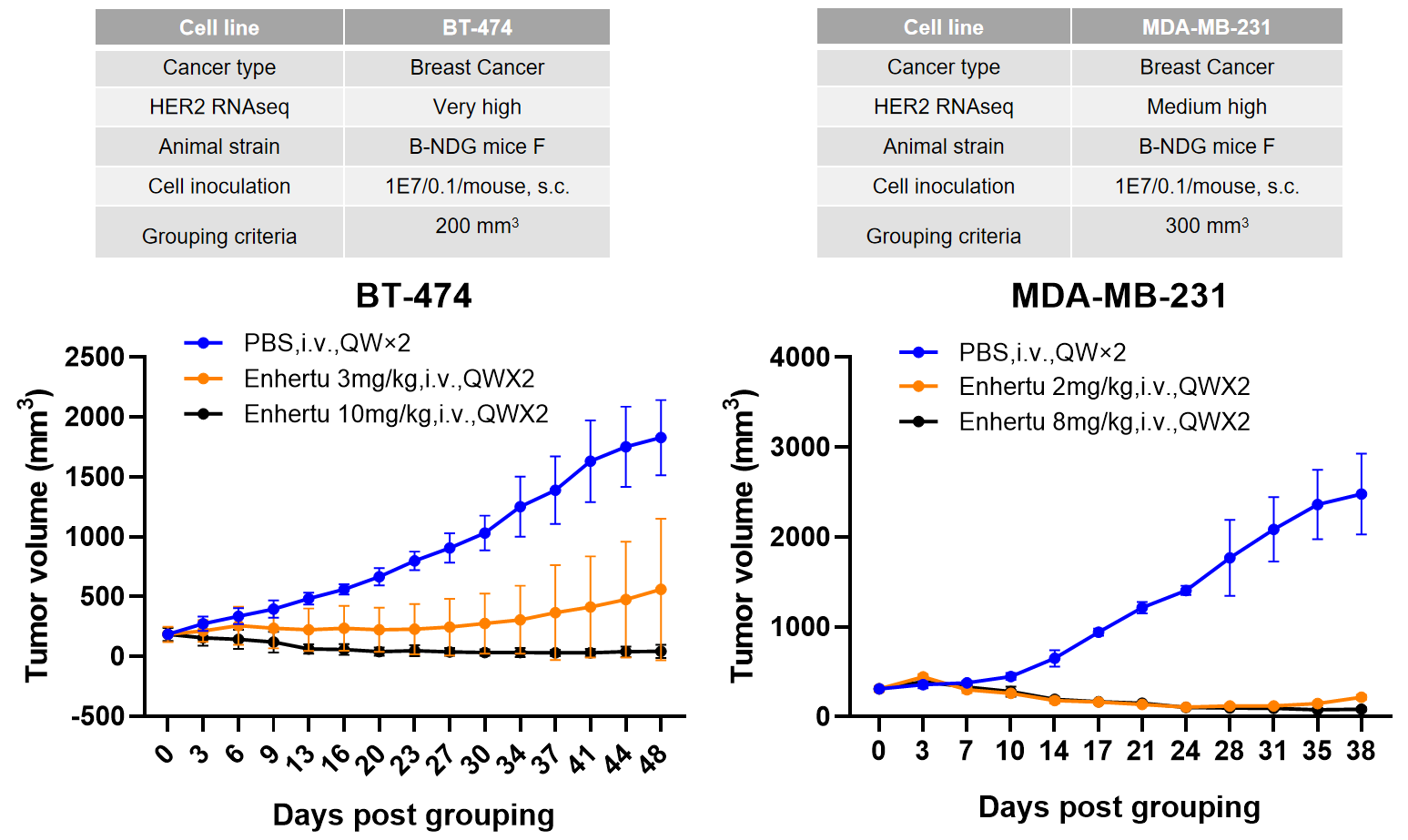
췌장암 세포주 B-luc MIA Paca-2를 정위 접종한 후, Her2-ADC 치료로 종양 성장 억제
정위 CDX 모델 목록을 보려면 여기를 클릭하십시오
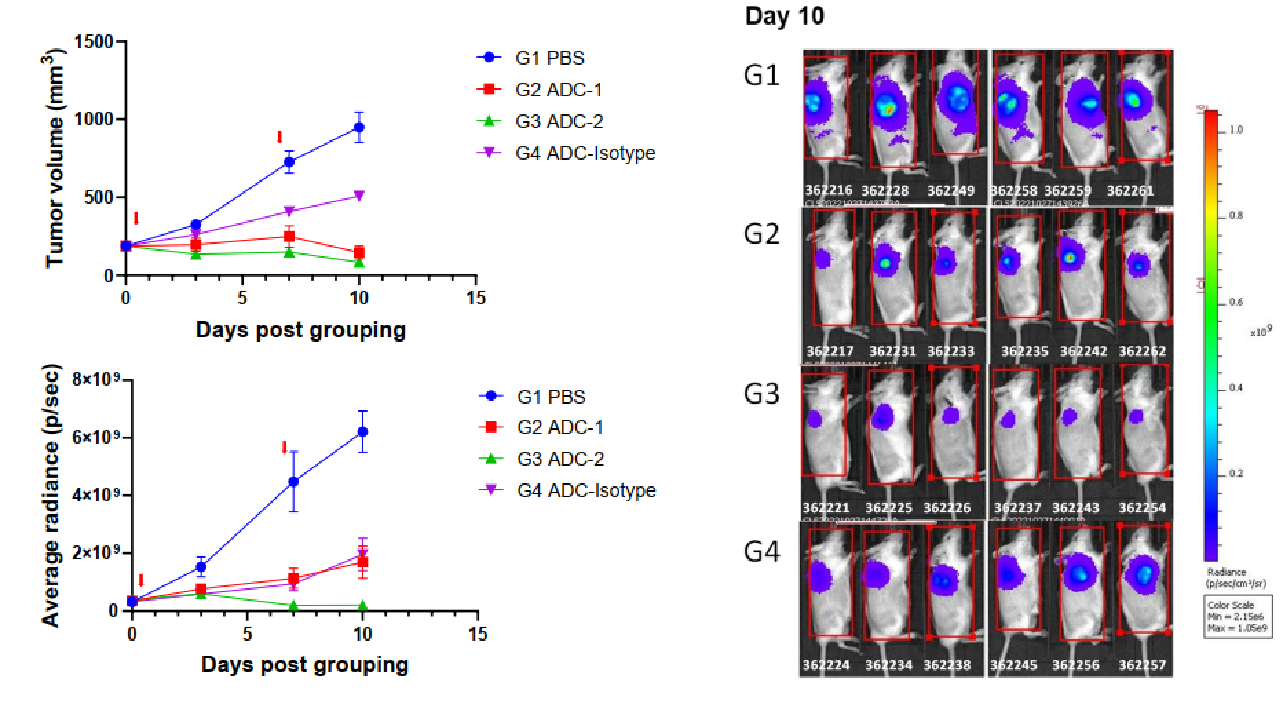
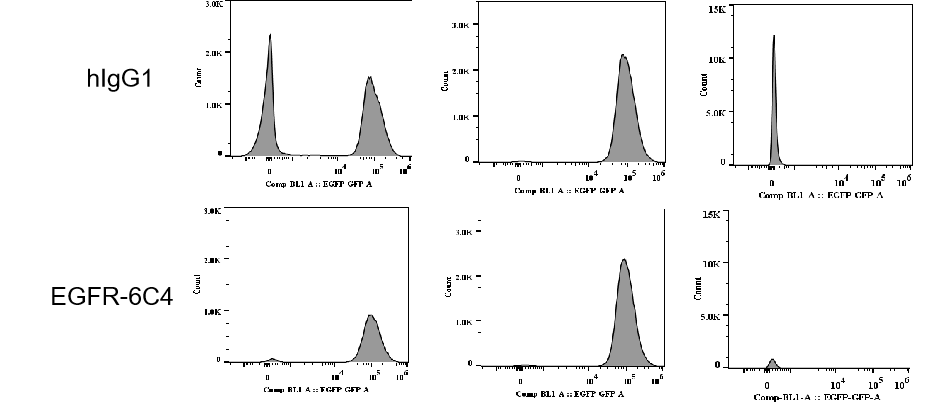
공접종 조건에서의 주변 세포 살상 in vivo. NCI-H1975 (타겟 양성) 및 B-luc Daudi (타겟 음성) ???포를 혼합 접종한 후 7일째, 마우스는 정맥 주사로 항체 약물 결합체 (0일, 7일)에 대한 처치를 받았습니다. 체내 이미징 장비를 통해 루시페레이스 활성을 측정했습니다. (왼쪽 위) 추정 종양 크기; (왼쪽 아래) 루시페레이스 활성; (오른쪽) 10일째 루시페레이스 활성을 측정한 영상 데이터 (n=6). 그림과 같이, ADC2는 B-luc Daudi의 성장을 유의미하게 억제하였고, ADC1은 효과가 없었습니다.
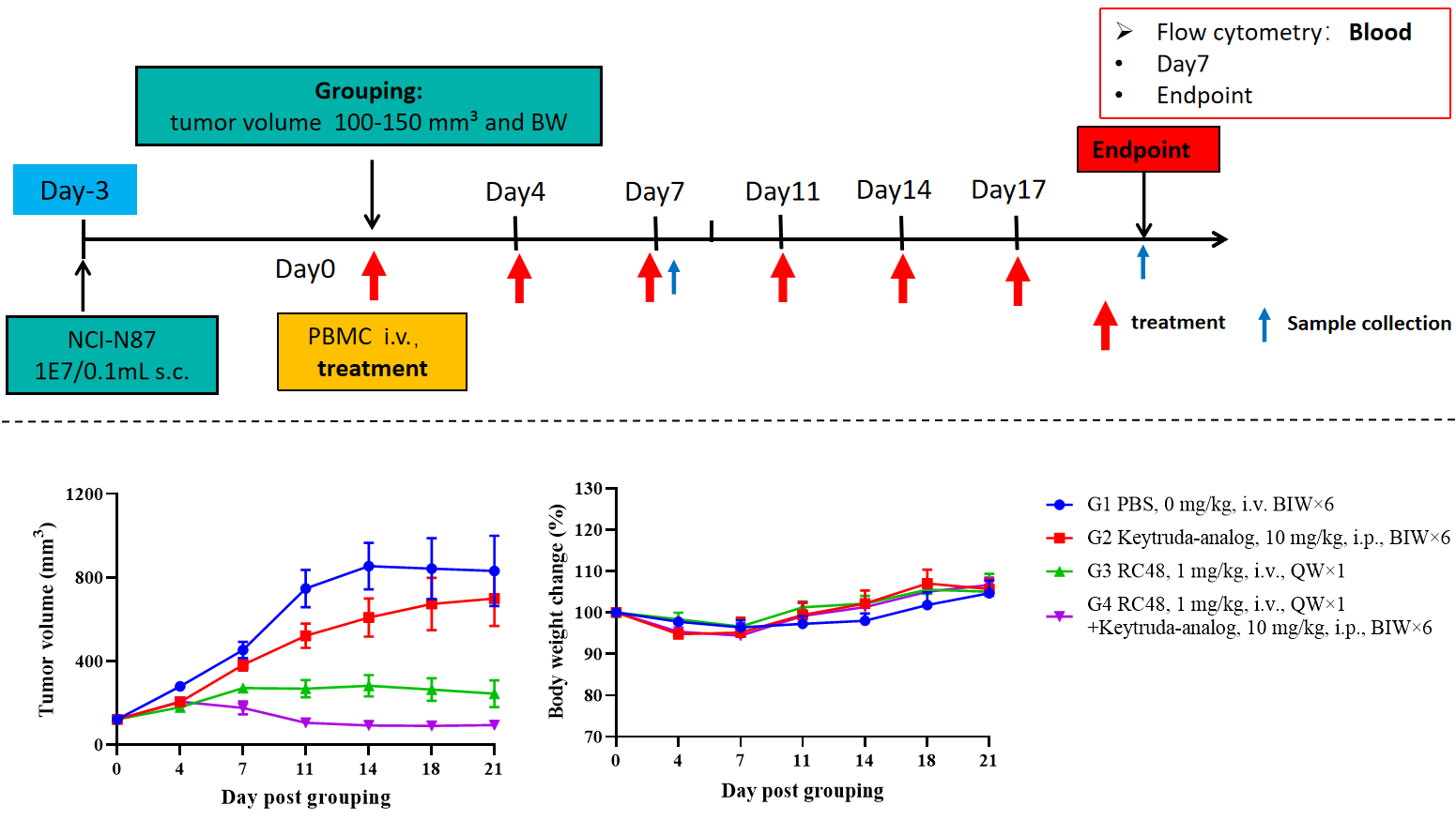
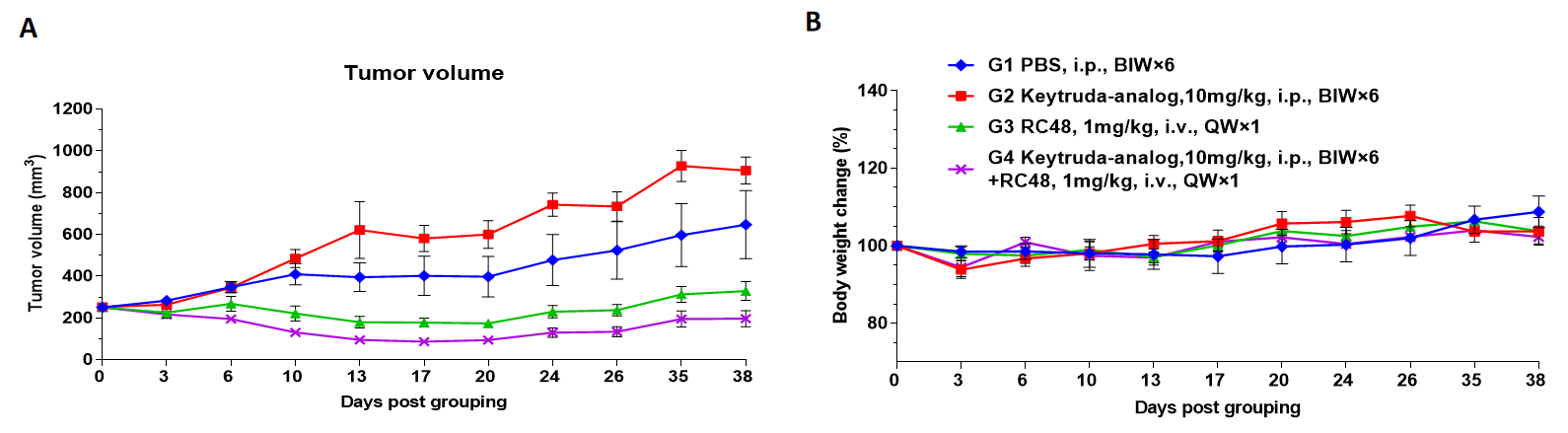
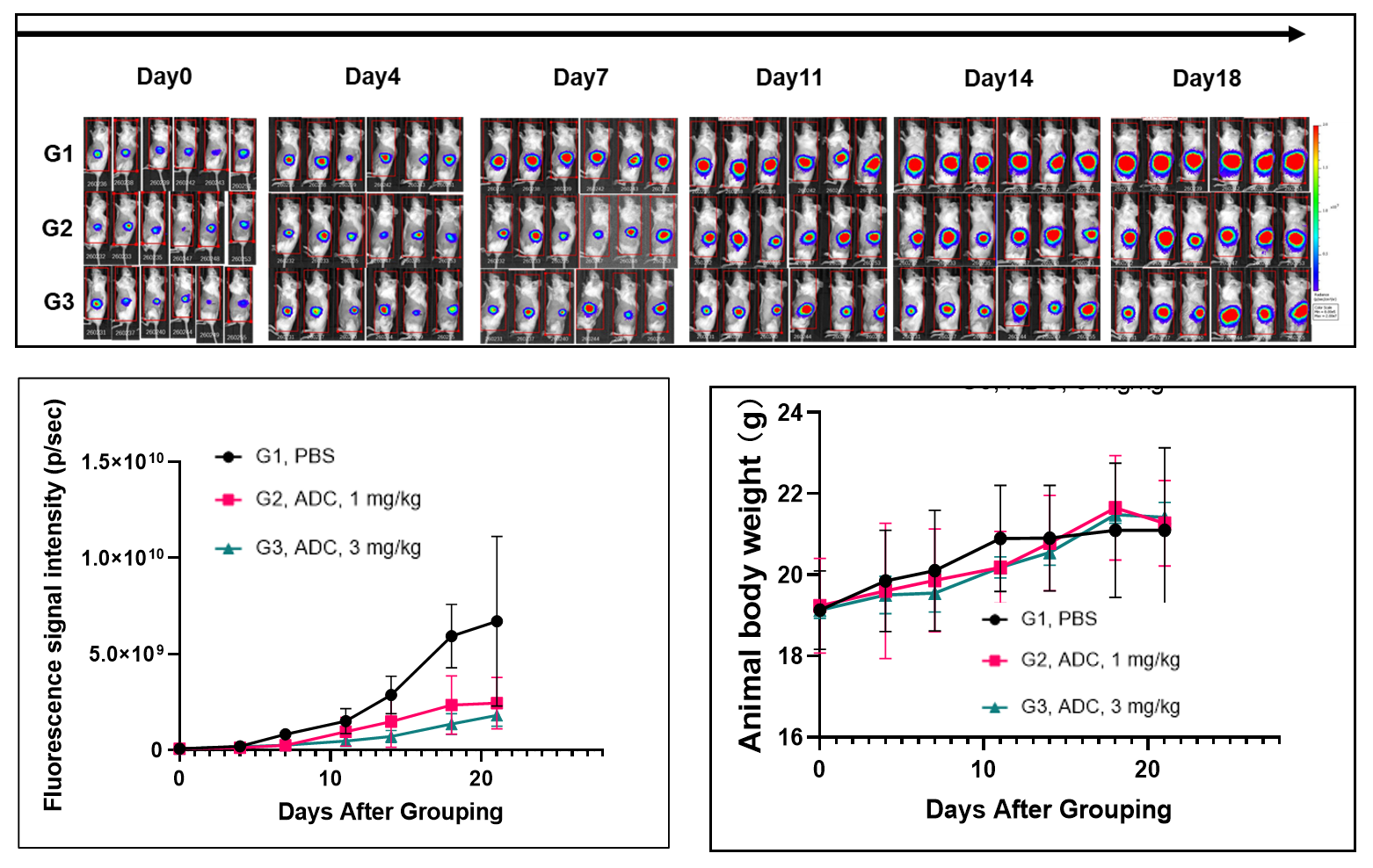
CD34+ 세포로 재구성된 B-NDG hIL15 마우스를 약물 효능 연구에 사용.
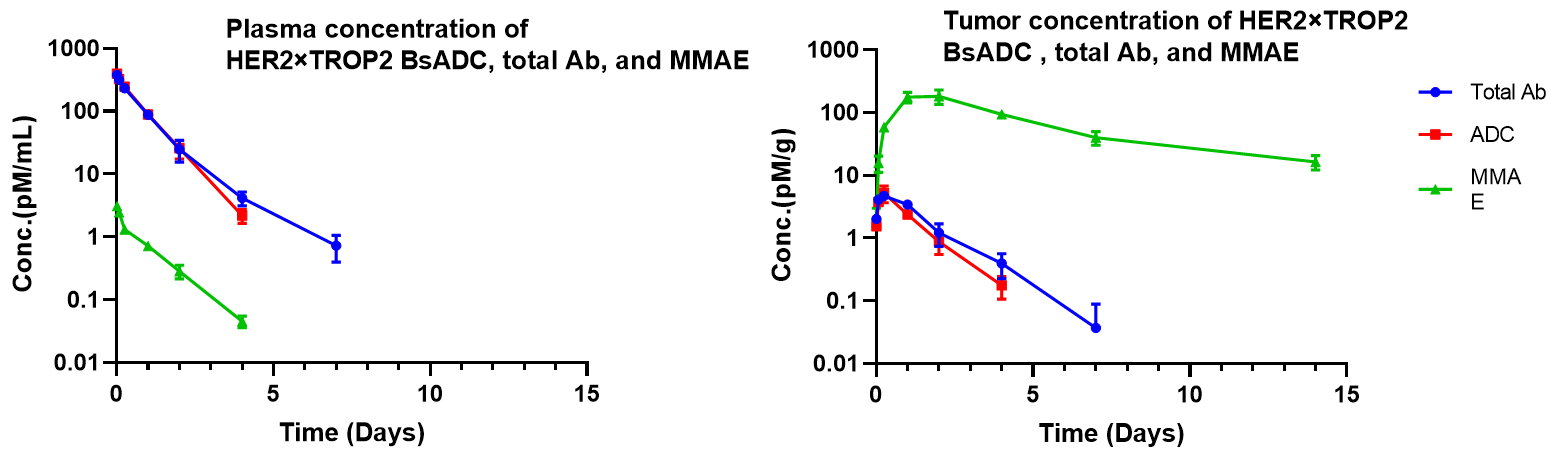
NCI-H1975 이식 모델에서 HER2×TROP2 BsADC의 약리학적 분석. 3 mg/kg의 HER2×TROP2 BsADC를 단일 용량으로 투여한 후, MMAE는 종양에 축적되었지만 혈장에서 낮은 수준으로 존재했습니다. 이는 HER2×TROP2 BsADC가 효율적인 종양 타겟 전달을 통해 MMAE를 전달하며, 더 나은 항암 활성을 가질 수 있음을 시사합니다.