당신도 좋아할 수 있습니다
最近,体内CAR-T已从概念验证走向临床实践。例如,比利时EsoBiotec开发的BCMA靶向in vivo CAR-T产品ESO-T01已在中国启动IIT临床试验,首批早期数据预计将于2025年下半年公布。与此同时,阿斯利康以高达10亿美元完成对EsoBiotec的收购,其中首付款4.25亿美元,彰显出跨国药企对这一模式的高度认可[1]。不仅如此,Gilead旗下的Kite Pharma也以3.5亿美元收购Interius,进一步巩固其体内CAR-T递送技术布局[2]。业内预计,截至2025年底,全球在研的in vivo CAR-T项目将超过100个,临床试验数量仍在持续扩张[3]。
CAR-T细胞疗法自2017年首获FDA批准以来,凭借在血液肿瘤中的显著疗效,彻底改变了肿瘤治疗的格局。然而,传统CAR-T模式基于体外制备(ex vivo),需要从患者体内采集T细胞,经过病毒转导、扩增,再回输回患者体内。这一流程复杂、耗时4–6周,且费用高昂,每个疗程成本高达45–50万美元[4]。这种个体化制造不仅限制了CAR-T的可及性,还让全球治疗普惠化举步维艰。
为了突破传统CAR-T制备的瓶颈,体内CAR-T(in vivo CAR-T)模式应运而生。该策略利用病毒或纳米颗粒递送系统,将CAR基因直接注入患者体内,使自身T细胞在体内转化为CAR-T,免去体外培养环节,实现“体内制造”。相比传统的体外CAR-T,体内CAR-T在多个方面展现出颠覆性优势:不仅简化了细胞分离、扩增和回输等复杂流程,还因制剂可标准化、规模化生产,具备可控的批次差异和“现货”特性,从而显著降低制造与供应链成本。由此,体内CAR-T有望提升可及性,并拓展至更广泛的适应症领域,包括实体瘤及非肿瘤疾病,使细胞疗法从“高端定制”迈向“普惠应用”。这一模式同时大幅缩短制备周期、降低成本,推动CAR-T由个体化走向标准化甚至批量化生产。然而,其发展仍面临挑战,如如何实现对T细胞的精准递送、避免非特异性转导,以及如何控制体内表达的剂量和时效,以确保安全性[5]。
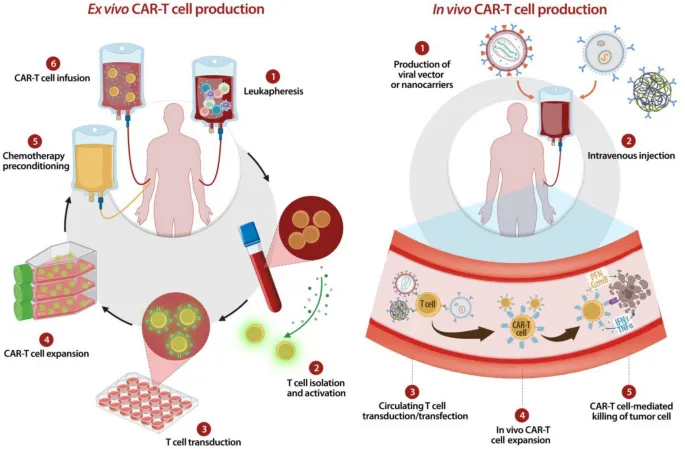
图1:体外(ex vivo)与体内(in vivo)CAR-T细胞制备[5]
CAR的基本框架由抗原识别结构(scFv或纳米抗体)、铰链区、跨膜区及胞内结构域(CD3ζ±共刺激信号)组成。在胞外的抗原识别结构是实现靶向识别和结合癌细胞的关键,使CAR-T细胞能够特异性识别癌细胞表面抗原并激活T细胞。在这一框架基础上,CAR的结构随着设计优化经历了五代演进:第一代仅包含CD3ζ胞内信号结构域,能够激活T细胞但细胞毒性和抗肿瘤效能有限;第二代在CD3ζ的基础上引入了共刺激信号域,如CD28或4-1BB,从而显著增强了T细胞的扩增能力和持久性;第三代则同时加入两个共刺激信号,使功能上较前代有所提升;第四代(TRUCK)增加细胞因子如IL-12,不仅能发挥直接的细胞毒效应,还能重塑肿瘤微环境,以提高靶向特异性并减少脱靶风险;第五代在第二代基础上加入截短IL-2受体β链,实现药物依赖性调控,使疗法更精准,但仍面临脱靶与特异性不足的挑战[6]。
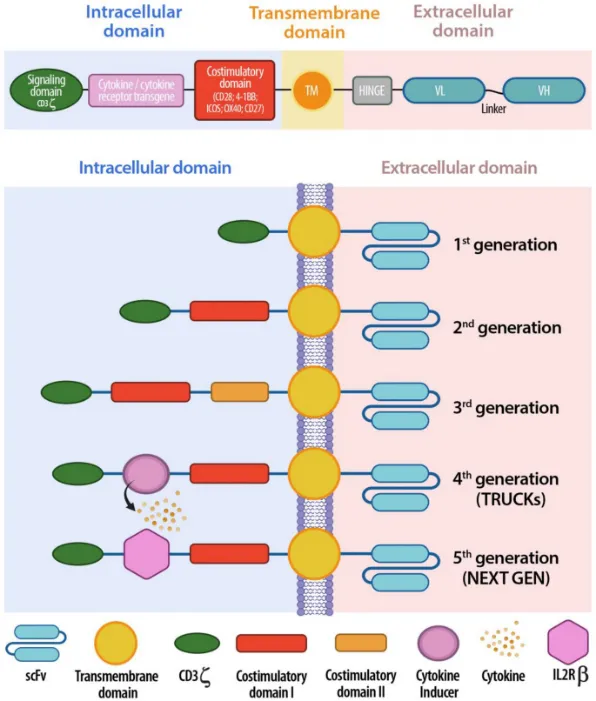
图2:CAR结构的五代演进[5]
在递送策略方面,体内CAR-T的核心技术可分为病毒类和非病毒类两大类。病毒类包括慢病毒(Lentivirus)和AAV,其中ESO-T01即采用慢病毒载体,其优势在于稳定整合、表达持久,但潜在的插入突变风险仍需关注[7]。非病毒类技术则主要包括脂质纳米颗粒(LNP)递送mRNA以及聚合物纳米颗粒等,它们能够实现短期表达、可重复给药,并具备更好的安全性和可控性,尤其适合引入药物开关等调节手段[8]。
从应用前景看,体内CAR-T最先切入的仍是血液肿瘤领域,如BCMA和CD19靶点。根据《柳叶刀》子刊报道,ESO-T01在早期试验中显示出可观疗效:4名受试者中,2例完全缓解(CR),2例部分缓解(PR)[9]。此外,在心血管疾病等非肿瘤领域,体内CAR-T也展现潜力,例如动物模型中,CD5靶向LNP递送FAP-CAR mRNA可改善心肌纤维化[10]。不过,目前尚无任何体内CAR-T疗法获批上市,但随着临床进展加速,未来3–5年将成为关键窗口期。
目前,体内CAR-T的发展仍存在诸多痛点,例如如何实现精准递送、避免非特异性转导,以及如何在体内控制CAR的表达剂量与时效性以保障安全性。为解决这些问题,临床前研究普遍依赖小鼠模型进行验证。通过在不同小鼠体系中测试递送方式和剂量,可以初步评估体内CAR-T的转染效率、扩增动力学和潜在毒性,为临床转化奠定基础。在验证体系上,免疫缺陷小鼠(如 NSG/NOG)常用于早期检测转导效率和抗肿瘤活性,而免疫健全小鼠(包括靶点人源化小鼠和免疫系统人源化小鼠)则因更接近临床环境,可进一步评估体内 CAR-T 的扩增动力学、持久性及安全性,从而为临床前研究提供更有力的实验数据支撑。关键考察指标不仅包括转导特异性、表达动力学、功能活性和毒性反应,还涉及可控性,例如能否通过药物(如dasatinib)快速关停CAR-T活性,以应对潜在的细胞因子释放综合征[5]。
百奥赛图基于其创新的技术平台,能够为体内CAR-T疗法开发提供关键临床前模型支持。百奥赛图不仅可提供高质量的人源化小鼠模型,还能利用免疫缺陷B-NDG小鼠开展体内CAR-T递送疗效及安全性评估,帮助企业验证临床前体内基因编辑及CAR表达效果,加速新药开发进程。
数据分享
B-NDG MHC I/II DKO mice plus
减轻GvHD反应,延长实验窗口期
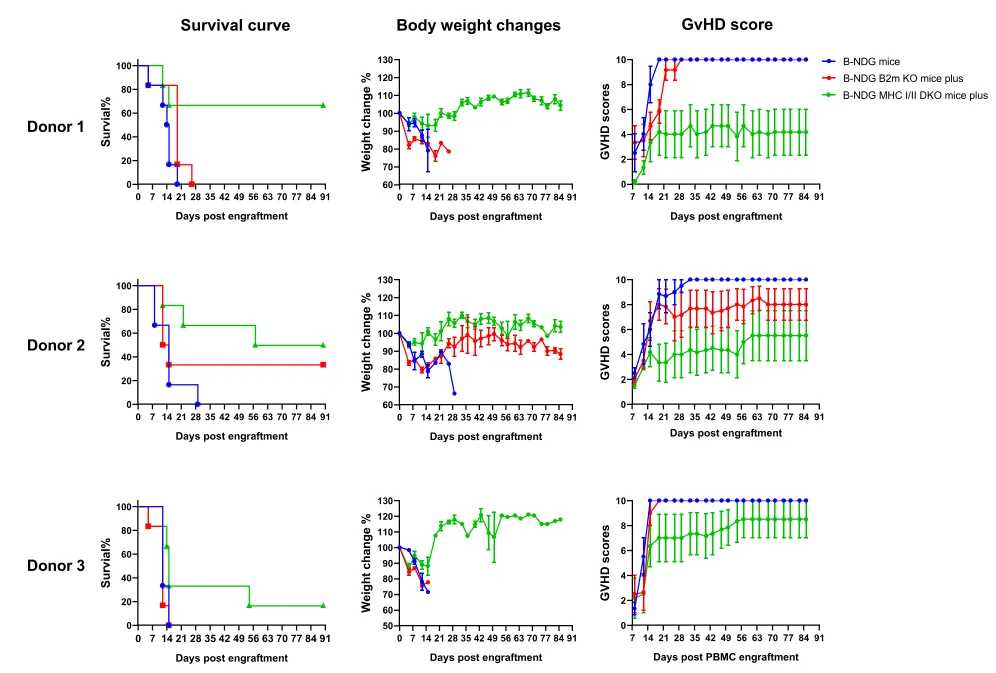
B-NDG MHC I/II DKO plus小鼠移植人PBMC后,生存期可以超过100天,GvHD的症状显著性减轻。重建2周开始,人T细胞的重建比例开始超过90%,直到16周结实验时,重建比例维持在近100%的水平。数值以均值 ± 标准误(SEM)表示。
人PBMC重建B-NDG MHC I/II DKO小鼠的体内药效评价
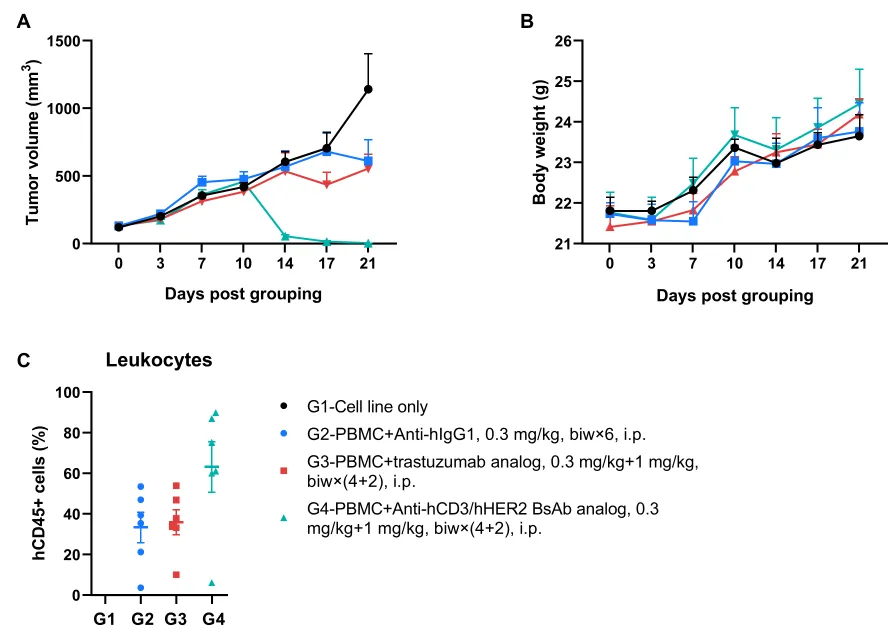
在B-NDG MHC I/II DKO plus小鼠中,通过移植人PBMC成功重建免疫系统,并建立NCI-N87人胃癌模型。实验显示,给予抗hCD3/hHER2双特异性抗体后,肿瘤生长被显著抑制,同时外周血中人CD45⁺细胞成功重建。数值以平均值±SEM表示。
B-hCD8 mice
B-hCD8小鼠中OVA诱导的免疫反应

结果显示,与野生型对照相比,B-hCD8小鼠在OVA刺激下能够正常分泌IFN-γ,提示其T细胞免疫功能正常。
综上,in vivo CAR-T已成为细胞治疗的新风口,集技术突破与资本热捧于一体,未来潜力巨大。然而,递送效率、靶向性和长期安全性仍是行业必须解决的核心问题。随着平台技术完善和临床数据积累,这一领域有望在未来5-10年实现产业化,并重塑细胞治疗格局。如果说传统CAR-T让我们看到免疫细胞药物化的曙光,那么体内CAR-T或许将真正实现细胞疗法的普惠化。
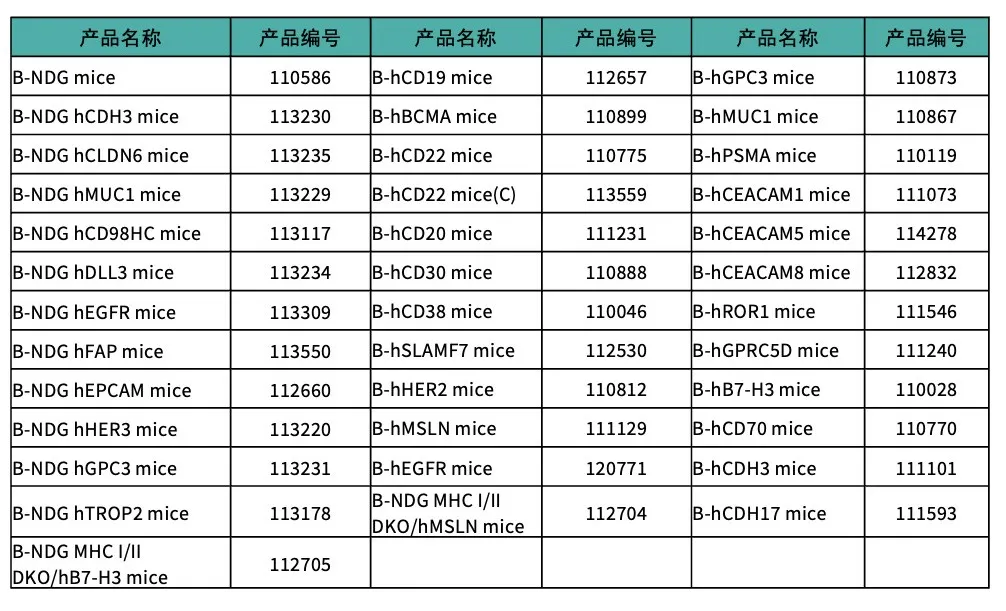
产品列表(部分展示)
百奥赛图in vivo CAR-T 相关模型
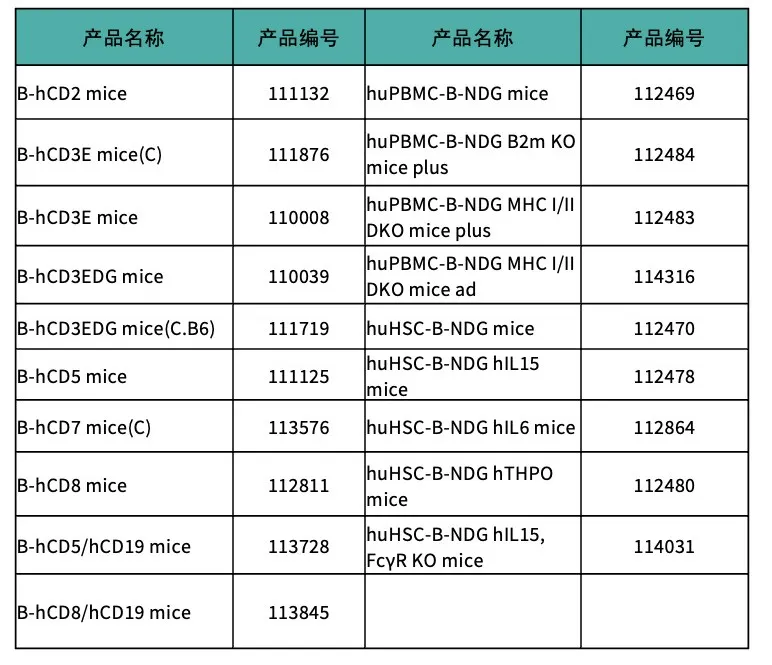
百奥赛图CAR-T 相关模型
参考资源
[1] Astrazeneca. (2025). Acquisition of EsoBiotec completed. https://www.astrazeneca.com/media-centre/press-releases/2025/acquisition-of-esobiotec-completed.html
[2] Gilead. (2025) Kite to acquire Interius Bio Therapeutics to advance in vivo platform. https://investors.gilead.com/news/news-details/2025/Kite-to-Acquire-Interius-BioTherapeutics-to-Advance-In-Vivo-Platform/default.aspx
[3] Novotech. (2025). In-vivo CAR-Therapies – Global research and development landscape. https://files.chinaasaservice.com/2053/18815960/Novotech-In-vivo-CAR-Whitepaper.pdf
[4] The Guardian. (2025). AstraZeneca pays up to $1bn for biotech firm 'that could transform cell therapy'. https://www.theguardian.com/business/2025/mar/17/astrazeneca-biotech-cancer-cell-therapy-esobiotec-imfinzi
[5] Pinto E, Lione L, Compagnone M, Paccagnella M, Salvatori E, Greco M, Frezza V, Marra E, Aurisicchio L, Roscilli G, Conforti A. (2025). From ex vivo to in vivo chimeric antigen T cells manufacturing: new horizons for CAR-T-cell based therapy. Journal of Translational Medicine 2025;23:10. doi: 10.1186/s12967-024-06052-3
[6] Bui TA, Mei H, Sang R, Ortega DG, Deng W. Advancements and challenges in developing in vivo CAR-T cell therapies for cancer treatment. eBioMedicine 2024;106:105266. doi: 10.1016/j.ebiom.2024.105266
[7] EsoBiotec. (2025). EsoBiotec doses first patient in investigator initiated trial of in vivo BCMA CAR-T candidate ESO-T01 for multiple myeloma. https://www.esobiotec.com/esobiotec-doses-first-patient-in-investigator-initiated-trial-of-in-vivo-bcma-car-t-candidate-eso-t01-for-multiple-myeloma/
[8] Song Z, Zhou Y, Wang B, Geng Y, Tang G, Wang Y, Yang J. In vivo production of CAR-T cell: Opportunities and challenges. Genes & Diseases 2025;12(6):101612. doi: 10.1016/j.gendis.2025.101612
[9] Xu J, Liu L, Parone P, Xie W, Sun C, Chen Z, Zhang J, Li C, Hu Y, Mei H. In-vivo B-cell maturation antigen CAR-T-cell therapy for relapsed or refractory multiple myeloma. Correspondence 2025;406(10500):228-231. doi: 10.1016/S0140-6736(25)01030-X
[10] Rurik JG, Tombacz I, Yadegari A, Fernandez POM, Shewale SV, Li L, Kimura T, Soliman OY, Papp TE, Tam YK, Mui BL, Albelda SM, Pure E, June CH, Aghajanian H, Weissman D, Parhiz H, Epstein JA. CAR-T cells produced in vivo to treat cardiac injury. Science 2022;375(6576):91-96. doi: 10.1126/science.abm0594