이 페이지에서
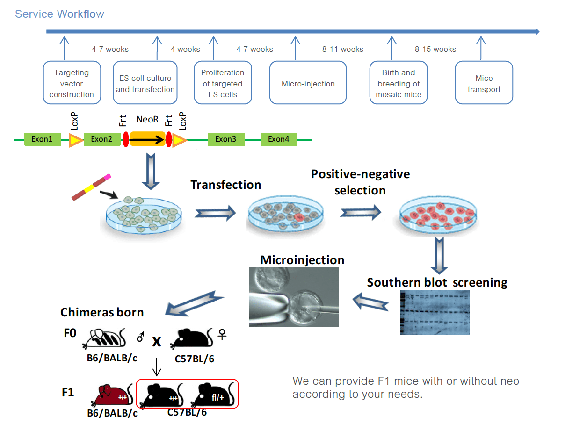
배아 줄기 세포 또는 ESC 기반의 유전자 타겟팅은 줄기 세포의 가소성을 활용하여 유전자 타겟 마우스를 생성하는 방법입니다. 먼저, 전기 천공을 통해 타겟팅 벡터를 줄기 세포에 삽입합니다. 타겟팅 벡터와 ESC 세포 DNA 사이에 성공적인 동원 재조합이 이루어진 후, 타겟 배아 줄기 세포는 정상 마우스의 배아에 주입됩니다. 주입 후, 줄기 세포는 배아 내에 정착하여 다양한 유전자형을 가진 키메라를 형성합니다. 이후 배아는 숙주 마우스에 이식되어 교배를 통해 타겟 유전자 배계 전이 마우스를 생성합니다.
전통적인 방법으로도 유전자 편집이 가능하지만, ESC/HR 기반 유전자 편집은 다음과 같은 장점을 제공합니다:

ESC를 기반으로 한 유전자 녹아웃 타겟팅에서는 타겟 유전자의 외인자들을 양성 선택 마커로 대체합니다. 타겟 유전자는 전신에서 제거되며, 조건부 녹아웃 동물에서는 특정 세포에서만 유전자가 제거됩니다. 조건부 녹아웃 마우스 모델은 일반적으로 Cre-LoxP 또는 Flp-Frt 리컴비네이션 시스템을 사용하여 생성됩니다.
녹인 마우스를 만들기 위해, 관심 있는 DNA 단편을 게놈 내 특정 위치에 삽입합니다. 이 방법은 점 돌연변이, 리포터 유전자(GFP), 태그(FLAG), Cre, 인간화 마우스 등 다양한 모델을 생성할 수 있게 합니다.
ES 세포를 사용한 타겟팅은 복잡한 타겟팅을 수행할 수 있으며, 6kb 이상의 큰 단편을 마우스 게놈에 삽입할 수 있습니다.
Biocytogen의 ES 세포는 100% 순수한 C57BL/6 배경을 가지고 있습니다. 이를 통해 최대 2년의 백크로스 시간을 절약할 수 있습니다.
프로젝트가 시작되면, 담당 프로젝트 매니저가 배정되어 매월 모델 진행 상황 업데이트가 제공됩니다. 또한 언제든지 프로젝트 매니저에게 연락할 수 있습니다.
타겟팅 벡터를 구성할 때, 양성 선택 마커(NEO 저항 유전자)와 DTA 음성 선택 마커가 도입되며, 타겟팅 벡터의 특정 위치에 제한효소 사이트가 추가됩니다. 타겟팅 벡터를 ES 세포에 전기천공 후, G418 선택으로 양성 세포를 스크리닝합니다. 또한, Southern blot을 사용하여 랜덤 삽입이 없음을 확인합니다. 더불어, 장기적인 인비트로 배양 중 ES 세포의 세포형 변화 모니터링을 위해 핵형 분석을 수행합니다. 염색체 밴딩 기술을 사용해 염색체를 분석, 비교, 서열 분석하며, 염색체의 길이, 중심체 위치, 팔 비율에 따라 번호를 매겨, 고품질의 ES 세포만을 마우스 배아에 주입합니다.
유전자 타겟팅에서 가장 중요한 것은 마우스 배아성 줄기세포 계통이며, 특정 계통은 다른 계통보다 타겟팅이 더 용이합니다. 문헌에서는 성공률이 0.5%~3%로 보고되고 있으며, 특정 사이트, 예를 들어 Rosa26 사이트에서는 타겟팅 효율이 높습니다. C57BL/6 계통의 ES 세포를 사용한 경우, 유전자 타겟팅 효율은 상대적으로 높습니다.